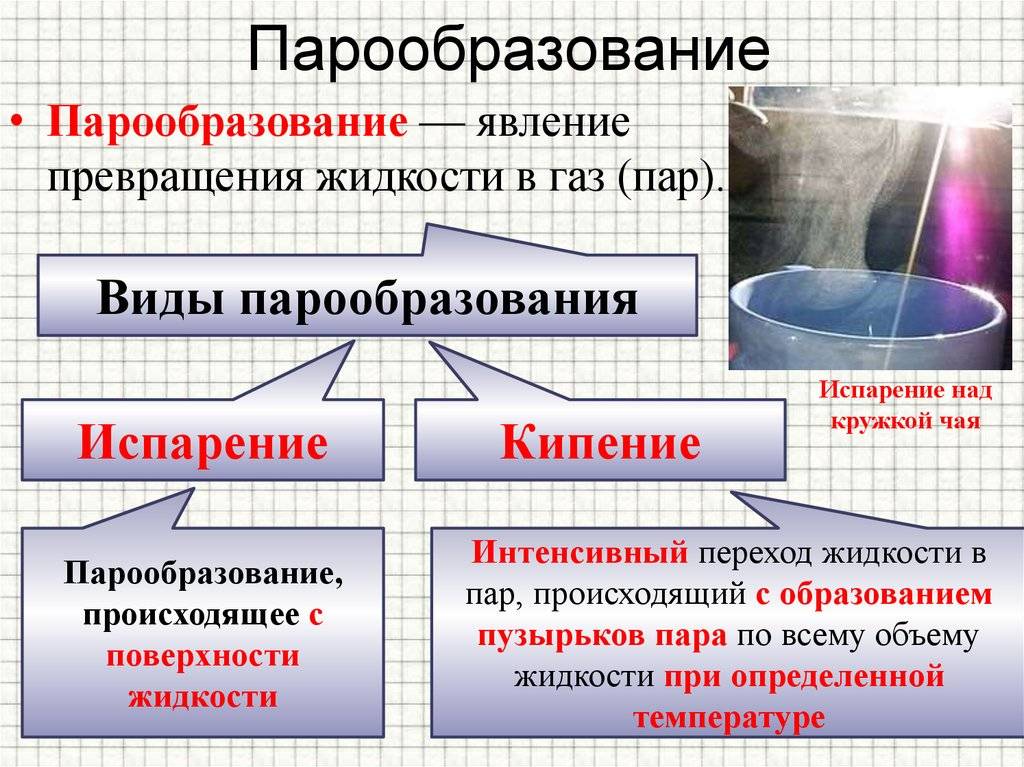
Что такое кипение
Кипение это интенсивное парообразование, которое происходит в результате нагревания жидкости, образования в ней пузырьков пара, всплывающих на поверхность и разрывающихся там.
Во время кипения температура жидкости остаётся постоянной.
Температура кипения это температура, при которой жидкость кипит. Обычно, говоря о температуре кипения данной жидкости, подразумевают температуру, при которой эта жидкость кипит при нормальном атмосферном давлении.
При парообразовании молекулы, которые отделились от жидкости, уносят из неё часть внутренней энергии. Поэтому при испарении жидкость охлаждается.
Роль явления
Испарение и кипение — очень распространённые физические явления, без которых стала бы невозможной нормальная жизнь на земле. Люди ежедневно сталкиваются с ним в быту, а также используют в промышленности, технике, энергетике и других сферах жизнедеятельности. Кроме того, фазовый переход жидкости и газа играет важную роль в существовании живых организмов и экосистеме планеты в целом.
В организме человека, животных и растений
Испарение играет важную роль в процессе саморегуляции температуры тела человека и большинства млекопитающих. Поскольку чрезмерное тепло для них вредно или даже смертельно (при 42,2 °C в крови происходит свёртывание белка, что приводит к быстрой смерти), в процессе эволюции организм разработал систему самоохлаждения — потоотделение. Она задействуется при пребывании в жарких или душных помещениях, тяжёлом физическом труде, болезнях.
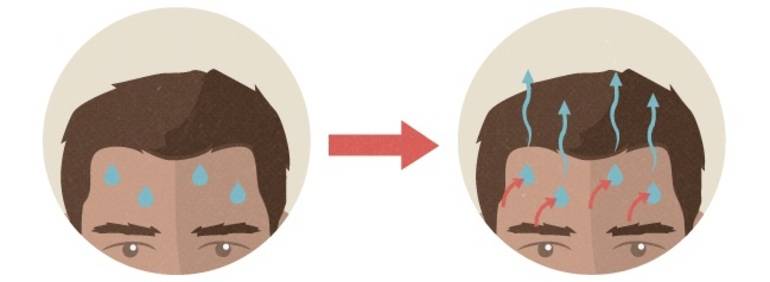
Через поры на коже выделяется жидкость, которая затем быстро испаряется. Это позволяет быстро избавиться от лишней энергии и охладить тело, нормализовав температуру. Некоторые животные инстинктивно пытаются усилить этот процесс — например, собаки в жаркую погоду открывают рот и высовывают язык.
Представители флоры обладают похожим защитным механизмом. Чтобы не перегреться на солнце, они запускают процесс испарения ранее поглощённой воды, тем самым охлаждаясь. Поэтому в летнюю пору садоводы усиленно поливают культурные растения, предотвращая их засыхание или выгорание в самые жаркие дни.
В природе и окружающей среде
Роль испарения и конденсации (превращение газа обратно в жидкость) в природе трудно переоценить. Они лежат в основе естественного круговорота воды, который обеспечивает экосистему необходимыми питательными веществами, спасает водоёмы от пересыхания, а животных и растений — от вымирания. Только благодаря этому явлению жизнь на земле может существовать в нынешнем виде.

Испарение большого количества воды с поверхности морей, океанов, рек и озёр приводит к появлению дождевых туч, которые разносят влагу по всему миру и питают окружающую среду. Это же явление препятствует затоплению и заболачиванию участков (особенно зимой, когда тают снега и льды), возвращая лишнюю воду обратно в мировой океан.
Благодаря испарению возможно такое явление, как запахи. Животные используют его во множестве сфер своей жизни — от охоты и поиска пищи до размножения и общения. Оно также помогает представителям фауны распознавать опасность в виде хищников или огня и дыма, обнаруживать токсичные вещества в атмосфере.
В быту и промышленности
Испарение широко применяется в бытовой жизни людей, а также в создании сложных механизмов и промышленных машин. Некоторые примеры использования этого процесса:

- создание охладителей для двигателей, ядерных реакторов, спускаемых аппаратов в космической технике;
- сушка различных вещей — от одежды до производственного сырья;
- запчасти бытовых и промышленных холодильников;
- кондиционирование и очищение воздуха;
- энергетическая промышленность;
- очистка различных веществ на молекулярном уровне;
- охлаждение воды;
- дегидрация продуктов для увеличения срока хранения, создание диетической еды путём вывода лишних веществ;
- готовка на пару в кулинарии;
- стимуляция процессов при химических опытах;
- декор и дизайн одежды — например, сублимационная фотопечать;
- оздоровительные процедуры — бани, криотерапия, косметические техники;
- медицинские ингаляции — приготовление насыщенных полезными веществами газов основано на процессе испарения.
Промышленная техника, использующая испарение для работы, строится по одной и той же схеме. В ней максимально увеличивается площадь поверхности жидкости, чем обеспечивается наилучший теплообмен с газовой средой. Это достигается за счёт разделения воды на отдельные струи и капли, а также образования тонких плёнок вещества на внутренней поверхности и насадках. Газ в приборах разгоняется, что также улучшает эффективность охлаждения.
Что такое испарение
Испарение – это переход жидкой фазы в газовую фазу. Это эндотермический процесс. Межмолекулярные силы между молекулами в жидкости должны быть разрушены, чтобы образовать ее пары. Эта реакция требует энергии. Следовательно, это эндотермическая реакция. Это противоположная реакция конденсации. Испарение напрямую связано с температурой. Когда температура увеличивается, скорость испарения также увеличивается.

Рисунок 2: Испарение воды с поверхности
Испарение жидкости происходит на поверхности жидкости. Молекулы вблизи поверхности жидкости имеют низкое количество межмолекулярных сил по сравнению с молекулами в середине или дне жидкости. Поэтому молекулы на поверхности могут быть освобождены легко. Эти молекулы первыми превращаются в газовую фазу.
Есть несколько факторов, которые влияют на скорость испарения. Некоторые из этих факторов приведены ниже.
- Концентрация вещества в воздухе – при высокой концентрации испаряющегося вещества в воздухе испарение происходит медленно.
- Расход воздуха – более высокий расход увеличивает испарение.
- Межмолекулярные силы – если межмолекулярные силы сильнее, энтальпия испарения высока. Затем испарение происходит медленно.
- Площадь поверхности – большая площадь поверхности полезна для более высокого испарения.
Что такое пароообразование?
Парообразованием называют изменение капельными жидкостями агрегатного состояния, в результате чего они из жидкости превращаются в пар.
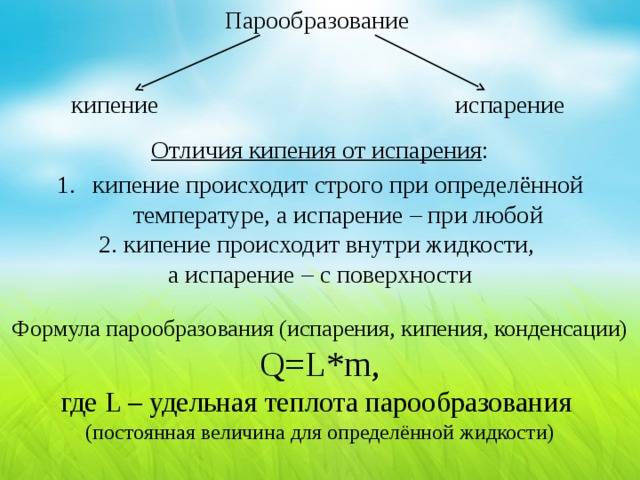
Если этот процесс происходит на поверхности воды, то он называется испарением. Когда он затрагивает весь объём, то происходит кипение, для чего нужно поддерживать конкретную температуру и давление насыщенного пара.
Кипение
Кипение — это процесс, происходящий внутри объёма жидкости. При комнатной t вода крайне насыщена воздухом, но в ней присутствуют пузырьки, свидетельствующие о наличии газа.
При нагревании он будет выделяться на стенки и дно сосуда. Это приводит к формированию воздушных пузырьков, а, находящаяся в них жидкость, начнёт испаряться, если давление пара станет больше давления газа, находящегося в пузырьках.
В процессе нагревания, наполненные паром пузырьки расширяются, что приводит к их всплыванию на поверхность. При кипении в жидкости всё время формируются пузырьки пара, через которые она испаряется. Для этого нужна определённая температура и давление.
При достижении температуры кипения молекулы начинают наращивать и поглощать тепловую энергию и энергию движения тела. Это приводит к увеличению скорости испарения, которое будет происходить, пока воздушные массы остаются насыщенными.
Если давление внешней среды приравняется к внутреннему молекулярному давлению жидкости, начнет происходить кипение, сопровождающееся преобразованием воды в пар.
Кипение бывает двух видов:
- Пузырьковое. Пузырьковое кипение заключается во время от времени появляющихся и увеличивающихся пузырьках. Если этот процесс происходит медленно, то они наполняются паром. Их увеличение в размерах происходит за счёт быстрого испарения жидкости, что провоцирует их всплытие и образование пара.
- Плёночное. Плёночное кипение возникает, когда некоторые пузырьки сливаются вместе до определённой критической отметки. Это приводит к формированию сплошного слоя пара, который время от времени прорывается в тело жидкости.
Испарение
Испарение — процесс спонтанный, происходящий при температуре 20 — 25°C и спровоцированный перемещением высокоэнергетических молекул, переходящих в воздушную массу.
Находясь в жидкости, молекулы обладают некоторой степенью свободы и определённым количеством энергии движения тела, побуждающей их переходить в газовую фазу, справляясь со сдерживающим их напряжением. Переходят из жидкой в газообразную фазу молекулы, находящиеся на поверхности, так как им для этого нужно мало энергии.
Однако это доступно и молекулам, располагающимся глубже в структуре жидкости, при условии, что у них есть достаточная для этого энергия движения тела, позволяющая преодолеть сопротивление поверхности и не сталкиваться с другими молекулами, находящимися внутри.
Испарение будет происходить, пока, находящийся над жидкой средой, воздух будет оставаться ненасыщенным.
Только в этом случае воздух примет молекулы паров, поглощающие тепловую энергию. В результате процесса испарения происходит снижение температуры той части жидкости, которая не преобразуется в пар.
Испарение становится возможным благодаря следующим особенностям молекулярной структуры жидкости:
- молекулы расположены очень близко одна к другой;
- отсутствует привязка молекул к каким-либо центрам, что позволяет им свободно перемещаться по всему телу жидкости;
- существуют силы притяжения, связывающие молекулы между собой;
- молекулы всё время находятся недалеко от собственного положения равновесия.
Чтобы произошло испарение, необходимо выполнить одно важное условие: накопление молекулами энергии движении тела, которая будет выше их связи другими молекулами в структуре жидкости. Это позволит им вылетать с поверхности и образовывать над ней пар
Однако для молекул характерно хаотичное движение, в результате которого они возвращаются в жидкое состояние, а часть из них теряется безвозвратно. Оставшиеся в структуре тела жидкости молекулы характеризуются сокращением средних показателей энергия движения тела, что приведёт к снижению температуры.
Что такое испарение
Это спонтанный процесс, который происходит при комнатной температуре из-за движения высокоэнергетических молекул жидкости, выходящих в воздух. Молекулы в жидкости обладают определенной степенью свободы движения и обладают разным количеством кинетической энергии. Поэтому молекулы с большим количеством кинетической энергии имеют тенденцию уходить в газовую фазу, преодолевая напряжения, которые могут сдерживать их. Обычно молекулы, которые испаряются, находятся на поверхности жидкости, поскольку им требуется небольшое количество энергии для выхода из жидкой фазы. Однако меньший процент молекул, находящихся глубже в жидкости, может испаряться при условии, что они имеют достаточное количество кинетической энергии, чтобы пройти через поверхность жидкости, избегая столкновений внутри жидкости.
Испарение происходит до тех пор, пока воздух над жидкостью остается ненасыщенным. Это означает, что воздух над жидкостью должен быть способен принимать поступающие молекулы паров жидкости. Эти молекулы поглощают тепловую энергию жидкости, которая преобразуется в их кинетическую энергию. Следовательно, при испарении молекул жидкости температура остальной части тела жидкости снижается.
Процессы парообразования и испарения
Причиной распада жидкости с выветриванием из вещества лёгких фракций считается разница температур на границе фазного перехода: воздух обычно теплее жидкости, что и вызывает испарение. Процесс протекает медленно, когда ему не способствуют внешние факторы, отличается от кипения тем, что отделение пара происходит только с водной поверхности.
Если естественное парообразование с зеркальной глади озера может быть незаметным, то процесс перехода в пар кипением всегда является интенсивным. Наглядный пример бурного природного парообразования — гейзер, выбрасывающий из недр под давлением горячую воду с паром. На способность жидкости испаряться быстрее или медленнее влияют несколько факторов:
Для определения количества теплоты, необходимого для превращения 1 кг жидкости в пар, используется физическая величина, обозначаемая в физике буквой L. У воды при температуре 0ºС этот показатель равен 2500 кДж/кг, а в стадии кипения удельная теплота парообразования меньше — 2260. Для сравнения: у этилового спирта L =906, у эфира — 356 кДж на кг. Величина L =0 у воды при 374,15ºС.
Испарение и человек
Рассматривая различные примеры испарения, нельзя не вспомнить влияние этого процесса на организм человека.
Как известно, при температуре тела 42,2 °С белок в крови человека сворачивается, что ведет к смерти. Нагреваться человеческое тело может не только из-за инфекции, но и при выполнении физического труда, занятий спортом или во время пребывания в жарком помещении.

Организму удается сохранить приемлемую для нормальной жизнедеятельности температуру, благодаря системе самоохлаждения – потоотделению. Если температура тела повышается, через поры кожи выделяется пот, а потом происходит его испарение. Этот процесс помогает «сжечь» лишнюю энергию и способствует охлаждению организма и нормализации его температуры.
Кстати, именно поэтому не стоит безоговорочно верить рекламам, которые преподносят пот как главное бедствие современного общества и пытаются продать наивным покупателям всевозможные вещества для избавления от него. Заставить организм меньше потеть, не нарушая его нормальной работы, нельзя, а хороший дезодорант способен лишь маскировать неприятный запах пота. Поэтому, используя антиперспиранты, различные присыпки и пудры, можно нанести организму непоправимый вред. Ведь эти вещества забивают поры или сужают выводные протоки потовых желез, а значит, лишают тело возможности контролировать свою температуру. В случаях, если использование антиперспирантов все же необходимо, предварительно стоит проконсультироваться с врачом.
Температура кипения некоторых веществ
В таблице 1 представлены экспериментально полученные значения температуры кипения для различных веществ.
| Вещество | $t_{кип}, \degree C$ | Вещество | $t_{кип}, \degree C$ |
| Водород | -253 | Вода | 100 |
| Кислород | -183 | Ртуть | 357 |
| Эфир | 35 | Свинец | 1740 |
| Спирт | 78 | Медь | 2567 |
| Молоко | 100 | Железо | 2750 |
Талица 1. Температура кипения некоторых веществ (при нормальном атмосферном давлении)
{"questions":[{"content":"Какая температура кипения у свинца?<br />`input-1` $\\degree C$.","widgets":{"input-1":{"type":"input","inline":1,"answer":"1740"}}}]}В обычных условиях кислород является газом. Из таблицы мы видим, что его температура кипения равна $-183 \degree C$. При температуре ниже этой кислород будет жидким.
С другой стороны, вещества, которые мы обычно наблюдаем в твердом состоянии, имеют очень высокую температуру кипения. Например железо плавится и превращается в жидкость при температуре $1539 \degree C$. А чтобы заставить жидкое железо кипеть, необходимо довести его температуры в $2750 \degree C$.
Сравнительная таблица
| Основа для сравнения | кипение | выпаривание |
|---|---|---|
| Смысл | Кипение подразумевает процесс испарения, при котором жидкость непрерывно нагревается и превращается в газ. | Испарение – это естественный процесс, при котором жидкость меняет свою форму на газ из-за повышения температуры или давления. |
| явление | насыпной | поверхность |
| Требуемая температура | Происходит только при температуре кипения. | Происходит при любой температуре. |
| Пузыри | Образует пузыри | Не образует пузырьков. |
| энергии | Источник энергии не требуется. | Энергия поставляется окружающими. |
| Температура жидкости | Остается постоянным | Сокращает |
Что такое кипячение
Как уже упоминалось выше, кипение – это процесс испарения жидкости при нагревании до точки кипения. Температура, при которой жидкость начинает превращаться в парообразную форму, называется температурой кипения жидкости, и она является свойством жидкости. При нагревании молекулы внутри жидкости способны поглощать тепловую энергию и увеличивать ее кинетическую энергию. В результате скорость испарения увеличивается. Это происходит до тех пор, пока воздух остается ненасыщенным. Однако в тот момент, когда внутреннее давление жидкости становится равным внешнему давлению (атмосферному давлению), превращение молекул жидкости в пар называется «кипением».
Этот процесс происходит при постоянной температуре, и температура остается постоянной, пока все жидкое тело не изменится в парообразную форму. В отличие от испарения, все жидкое тело участвует в процессе кипения.

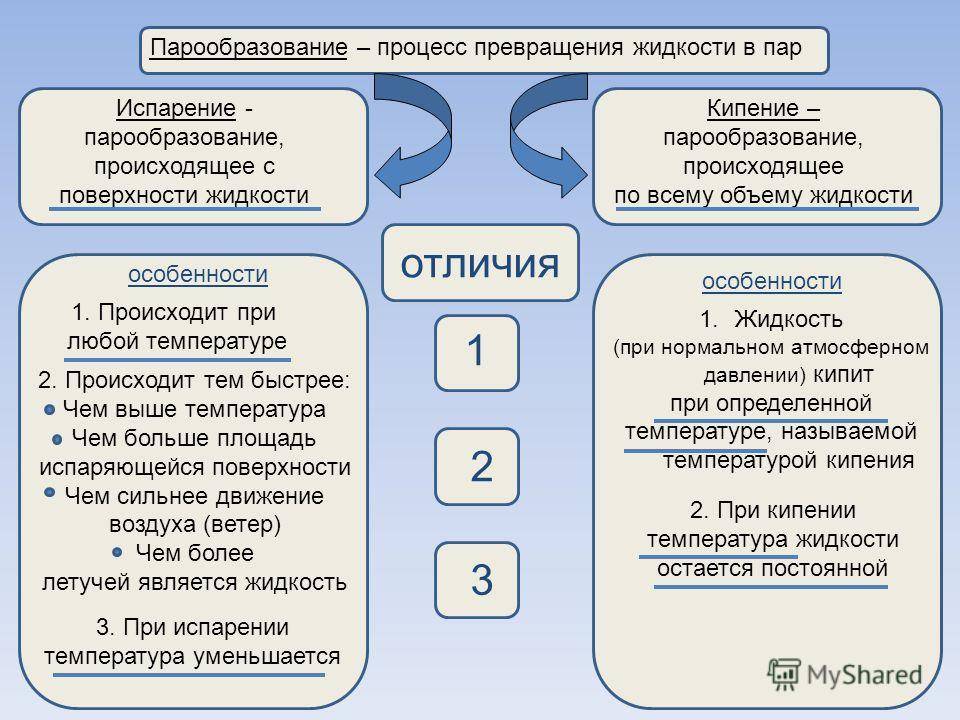
Основные различия между кипением и испарением
Приведенные ниже пункты заслуживают внимания, поскольку они объясняют разницу между кипением и испарением:
- Кипение относится к процессу испарения, при котором жидкое состояние превращается в газообразное состояние с определенной температурой кипения. Напротив, испарение определяется как естественный процесс, при котором повышение температуры и / или давления превращает жидкость в газ.
- Кипение является массовым явлением в том смысле, что оно происходит во всей жидкости. И наоборот, испарение – это поверхностные явления, которые происходят только на поверхности жидкости.
- Кипение жидкости происходит только при температуре кипения этой жидкости, то есть только при определенной температуре. В отличие от этого процесс испарения может происходить при любой температуре.
- При кипении пузырьки образуются внутри жидкости, затем они поднимаются и превращаются в газ, тогда как в процессе испарения пузырьки не образуются.
- В то время как источник энергии требуется в процессе кипения, энергия испарения обеспечивается окружающими.
- При кипении температура жидкости остается неизменной, тогда как в случае испарения температура жидкости имеет тенденцию к снижению.
Заключение
Подводя итог, можно сказать, что кипение является более быстрым процессом по сравнению с испарением, так как молекулы жидкости движутся быстрее при кипении, чем в процессе испарения. В то время как кипячение производит тепло и не вызывает охлаждения жидкости, испарение приводит к охлаждению жидкости.
Маргелов василий филиппович биография кратко
Перечислите и кратко охарактеризуйте существенные признаки сознания
Казань в годы вов кратко
Растения лесостепи в россии кратко
- Белинский о гамлете шекспира кратко
Определение кипения
Кипение – это физическое изменение и тип быстрого испарения, при котором жидкость превращается в пар, когда она постоянно нагревается до такой температуры, что давление пара жидкости такое же, как внешнее давление, оказываемое окружающим.
Температура, при которой начинается кипение, называется температурой кипения. Это зависит от давления, оказываемого на жидкость, т.е. чем больше давление, тем выше будет температура кипения. В процессе кипения, когда молекулы вещества настолько распространены, что оно может изменить свое состояние, образуются пузырьки и начинается кипение.
В этом процессе, когда мы нагреваем жидкость, давление пара возрастает, пока оно не станет равным атмосферному давлению. После этого в жидкости будет происходить образование пузырьков, которые будут перемещаться на поверхность и взрываться, что приведет к выделению газа. Даже если мы добавим больше тепла к жидкости, температура кипения будет такой же.
Что такое газ?
Газ в природе может состоять из одного элемента или комбинации атомов. Однако это очень маленькая молекула. Например, если рассматривать группу галогенов в периодической таблице, фтор и хлор существуют в виде газов, тогда как бром существует в виде жидкости, а йод – в твердом состоянии.Это связано с тем, что размер атома увеличивается вниз по группе галогена, и большие молекулы не могут получить состояние свободного движения из-за межмолекулярных взаимодействий.
Газ – это вещество, которое существует только в одном состоянии, а именно в газовой фазе. Это называется термодинамическим состоянием. Термодинамическое состояние – это состояние системы, объясняемое в соответствии с термодинамическими параметрами, такими как температура, давление и т. Д. Газ не подвергался фазовому превращению, что означает, что он существует только в виде газа и не будет претерпевать фазовых изменений, если не заданы особые условия. . Поэтому его называют однофазным веществом.
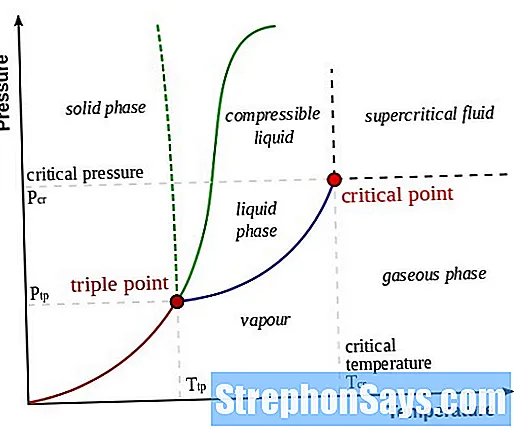
На следующей диаграмме показано относительное положение газовой фазы и паровой фазы. Здесь паровая фаза находится при более низкой температуре, чем температура критической точки. Газовая фаза находится выше критической точки.