Образование конденсата как завершение цикла
Одновременно с испарением при температуре кипения вещества происходит его превращение в жидкость. Хаотичное движение молекул над поверхностью воды или другого текучего субстрата приводит к их столкновению, а при совпадении векторов скорости в направлении к жидкости происходит возврат капель в кипящую среду. Конденсация длится на протяжении всего времени кипения, то есть пока температура остаётся равной 100ºС, если это вода. Другая часть испарившихся молекул улетучивается в атмосферу. В разных обстоятельствах взаимодействие парообразования и конденсации отличается:

- Сосуд с жидкостью открытый. Процесс испарения в этом случае превалирует — масса жидкости становится меньше, а пар над поверхностью называется ненасыщенным.
- Закрытая ёмкость. В начале перехода количество вылетающих из воды молекул преобладает над возвратом, но со временем под давлением пара в сосуде наступает динамическое равновесие. Число отделившихся капель сравнивается с количеством вернувшихся в воду молекул. В состоянии, когда влага в воздухе находится в устойчивом балансе с базовой жидкостью, пар называется насыщенным.
- Посуда с содержимым в равновесном динамическом состоянии. Если её нагреть, то вылетающих молекул станет больше, чем возвращающихся, но после баланс восстановится. При этом плотность пара и его давление над поверхностью жидкости увеличатся.
Круговорот воды обеспечивает окружающий человека мир и его самого полезными веществами, способствует сохранению естественной среды обитания живых организмов.
Основные положения молекулярно кинетической теории строения вещества
Основные положения молекулярно-кинетической теории молекулы:
- Все вещества могут быть в жидком, твердом и газообразном состоянии. Они образуются из частиц, которые состоят из атомов. Элементарные молекулы могут иметь сложное строение, то есть иметь в своем составе несколько атомов. Молекулы и атомы – электрически нейтральные частицы, которые в определенных условиях приобретают дополнительный электрический заряд и переходят в положительные или отрицательные ионы.
- Атомы и молекулы движутся непрерывно.
- Частицы с электрической природой силы взаимодействуют друг с другом.
Основные положения мкт и их примеры были перечислены выше. Между частицами имеется малое гравитационное воздействие.

Рисунок 3.1.1. Траектория Броуновской частицы.
Определение 2
Броуновское движение молекул и атомов подтверждает существование основных положений молекулярно кинетической теории и опытно обосновывает его. Данное тепловое движение частиц происходит с взвешенными в жидкости или газе молекулами.
«Испарение. Конденсация»
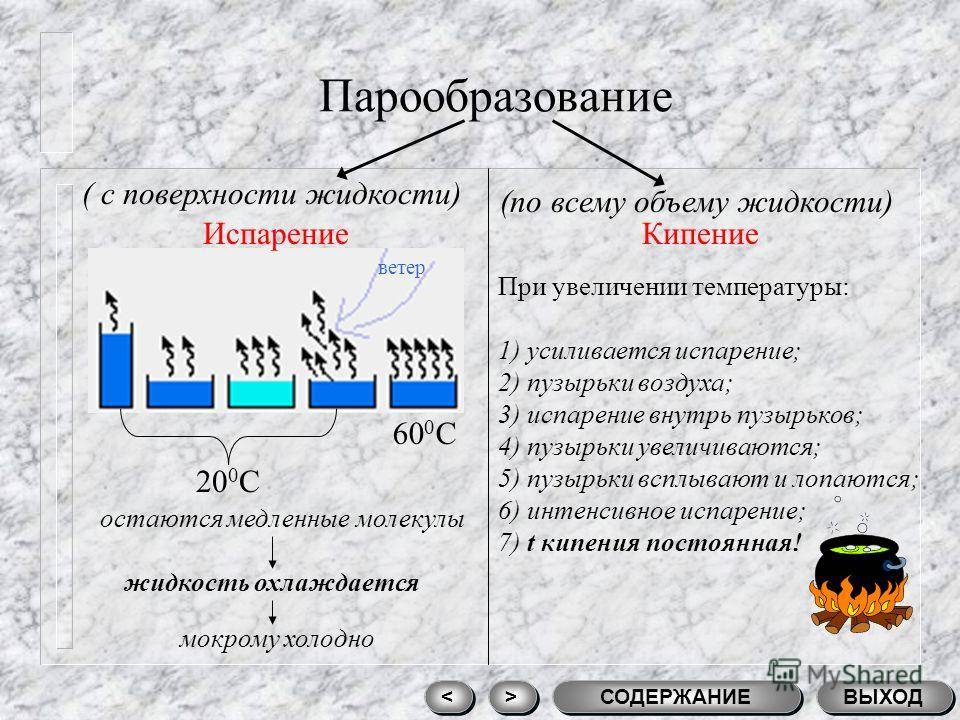
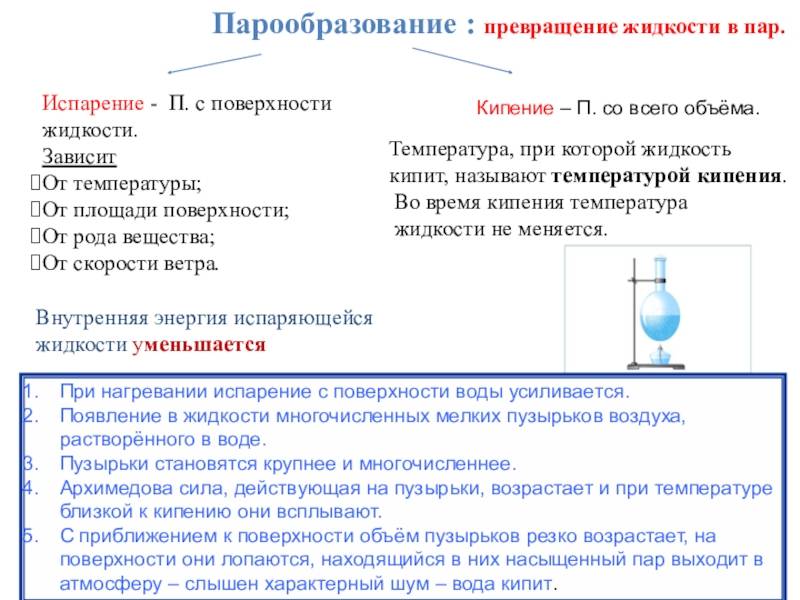
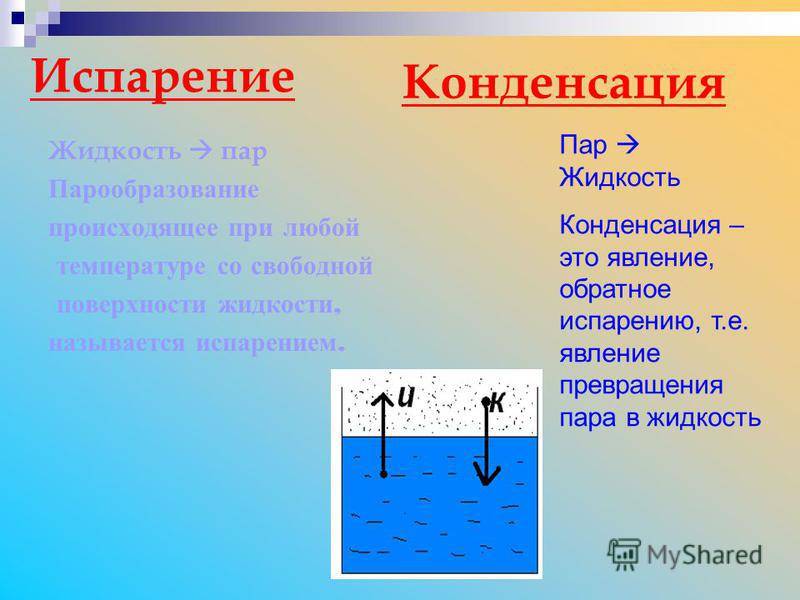
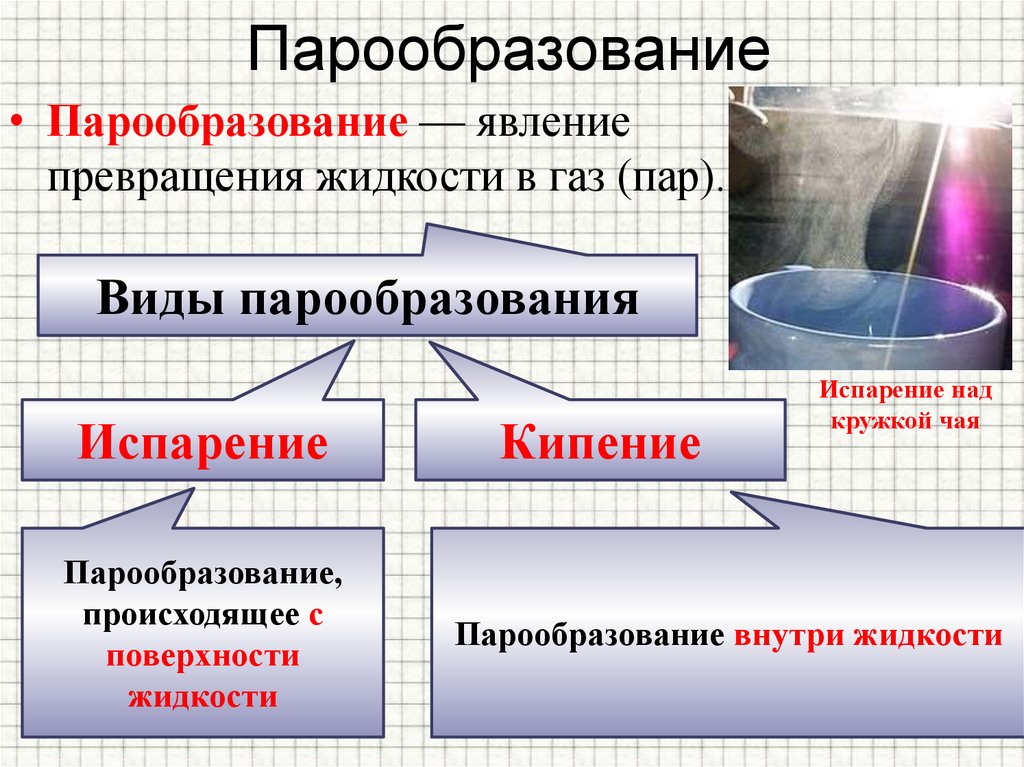
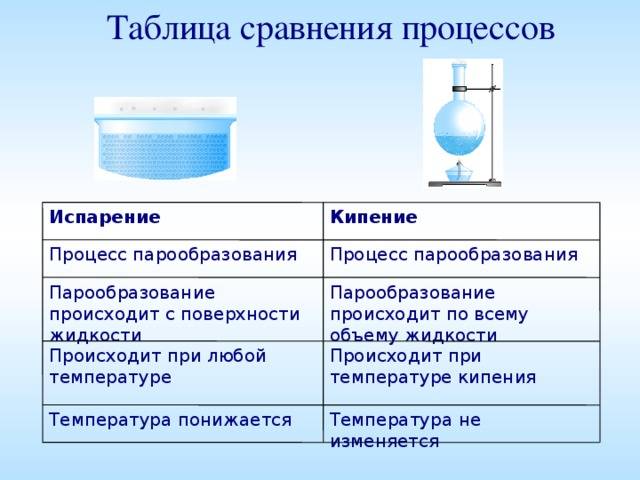
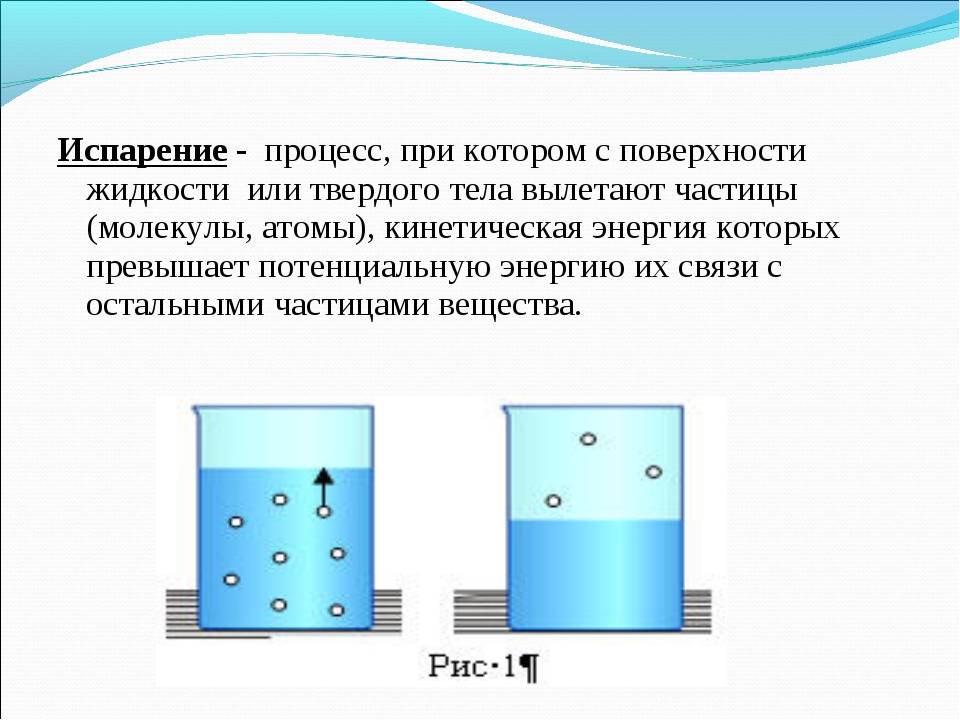
Явление превращения вещества из жидкого состояния в газообразное называется парообразованием. Парообразование может осуществляться в виде двух процессов: испарение и кипение.
Испарение
Испарение происходит с поверхности жидкости при любой температуре. Так, лужи высыхают и при 10 °С, и при 20 °С, и при 30 °С. Таким образом, испарением называется процесс превращения вещества из жидкого состояния в газообразное, происходящий с поверхности жидкости при любой температуре.
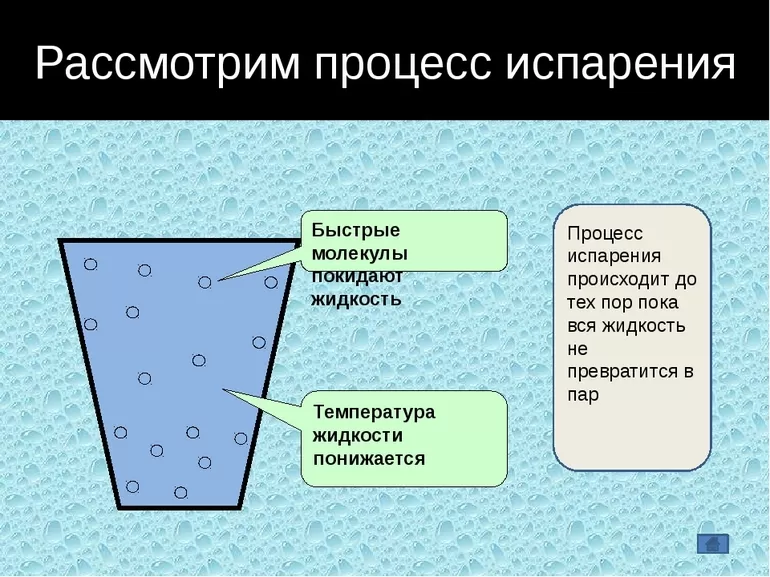
С точки зрения молекулярно-кинетической теории строения вещества испарение жидкости объясняется следующим образом. Молекулы жидкости, участвуя в непрерывном движении, имеют разные скорости. Наиболее быстрые молекулы, находящиеся на границе поверхности воды и воздуха и имеющие сравнительно большую энергию, преодолевают притяжение соседних молекул и покидают жидкость. Таким образом, над жидкостью образуется пар.
Поскольку из жидкости при испарении вылетают молекулы, обладающие большей внутренней энергией по сравнению с энергией молекул, остающихся в жидкости, то средняя скорость и средняя кинетическая энергия молекул жидкости уменьшаются и, следовательно, температура жидкости уменьшается.
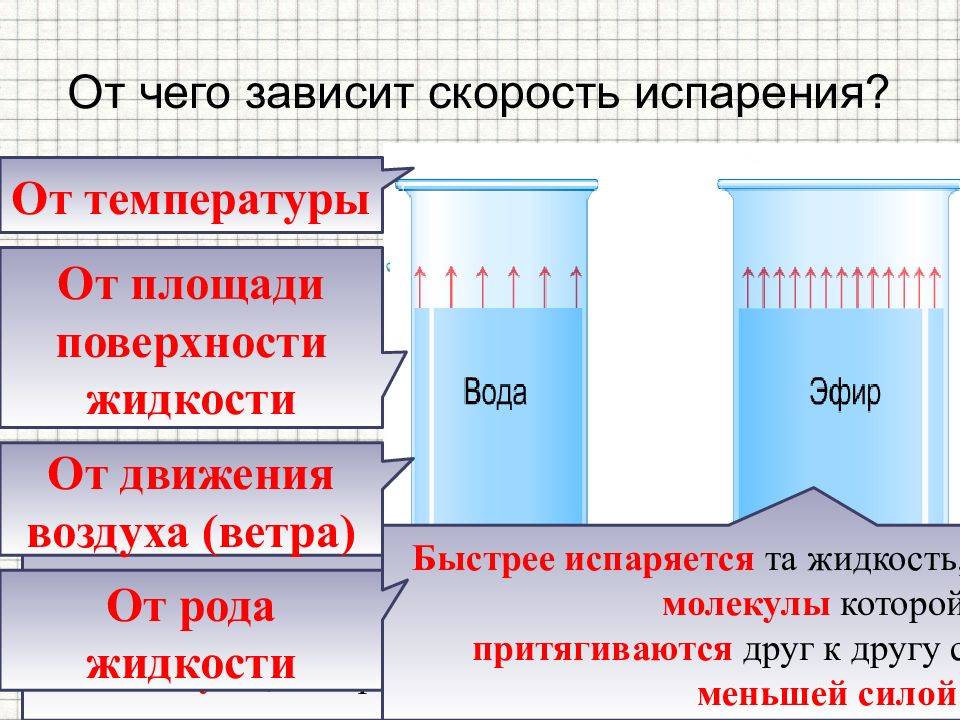
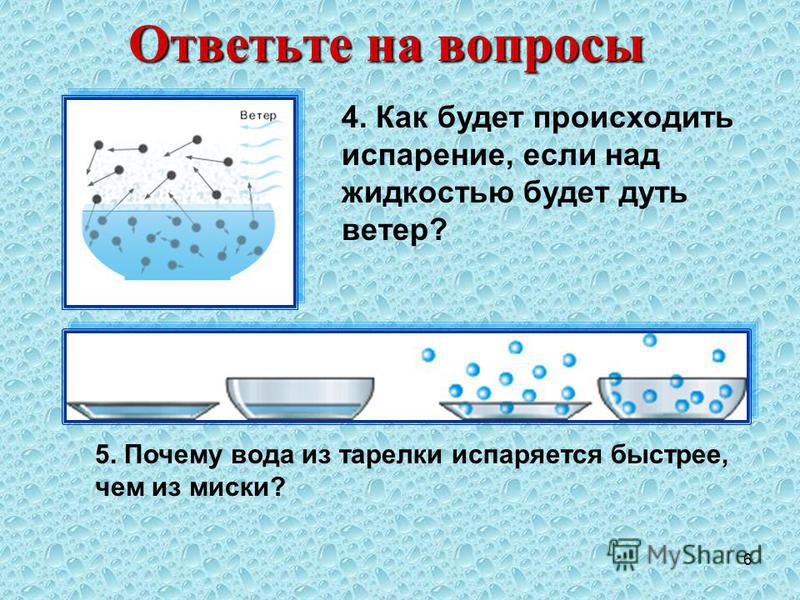
Скорость испарения жидкости зависит от рода жидкости. Так, скорость испарения эфира больше, чем скорость испарения воды и растительного масла. Кроме того, скорость испарения зависит от движения воздуха над поверхностью жидкости. Доказательством может служить то, что бельё сохнет быстрее на ветру, чем в безветренном месте при тех же внешних условиях.
Скорость испарения зависит от температуры жидкости. Например, вода при температуре 30 °С испаряется быстрее, чем вода при 10 °С.
Хорошо известно, что вода, налитая в блюдце, испариться быстрее, чем вода такой же массы, налитая в стакан. Следовательно, скорость испарения зависит от площади поверхности жидкости.
Конденсация
Процесс превращения вещества из газообразного состояния в жидкое называется конденсацией.
Процесс конденсации происходит одновременно с процессом испарения. Молекулы, вылетевшие из жидкости и находящиеся над её поверхностью, участвуют в хаотическом движении. Они сталкиваются с другими молекулами, и в какой-то момент времени их скорости могут быть направлены к поверхности жидкости, и молекулы вернутся в неё.
Если сосуд открыт, то процесс испарения происходит быстрее, чем конденсация, и масса жидкости в сосуде уменьшается. Пар, образующийся над жидкостью, называется ненасыщенным.
Если жидкость находится в закрытом сосуде, то вначале число молекул, вылетающих из жидкости, будет больше, чем число молекул, возвращающихся в неё, но с течением времени плотность пара над жидкостью возрастет настолько, что число молекул, покидающих жидкость, станет равным числу молекул, возвращающихся в неё. В этом случае наступает динамическое равновесие жидкости с её паром.
Пар, находящийся в состоянии динамического равновесия со своей жидкостью, называется насыщенным паром.
Если сосуд с жидкостью, в котором находится насыщенный пар, нагреть, то вначале число молекул, вылетающих из жидкости, увеличится и будет больше, чем число молекул, возвращающихся в неё. С течением времени равновесие восстановится, но плотность пара над жидкостью и соответственно его давление увеличатся.
Конспект урока по физике в 8 классе «Испарение. Конденсация».
Следующая тема: «Кипение. Удельная теплота парообразования».
Пар для личных нужд
 Поэтому в поиске новых открытий старались уточнить допустимые параметры пара. Более точные исследования стартовали намного позже, когда пар стал применяться в промышленности, когда развитие паровых машин преобразило мир. Стало необходимо точно рассчитать ту силу, которую пар несет в себе, которой может передвигать поршни и вращать колеса. Классическая физика Ньютона в тот момент перестала быть полезной – она была создана для твердых тел, а влага не представляла собой такое. Даже если на поверхности тела находится немного жидкости, то уже в этом случае невозможно было бы рассчитать потенциальные взаимодействия тел.
Поэтому в поиске новых открытий старались уточнить допустимые параметры пара. Более точные исследования стартовали намного позже, когда пар стал применяться в промышленности, когда развитие паровых машин преобразило мир. Стало необходимо точно рассчитать ту силу, которую пар несет в себе, которой может передвигать поршни и вращать колеса. Классическая физика Ньютона в тот момент перестала быть полезной – она была создана для твердых тел, а влага не представляла собой такое. Даже если на поверхности тела находится немного жидкости, то уже в этом случае невозможно было бы рассчитать потенциальные взаимодействия тел.
Из-за испарения воды также происходили изменения во взаимодействиях тел. Охлаждение, деформация – все это было следствием выброса молекул жидкости из основного объема влаги. Интересно, насколько же сильно могло быть воздействие? Давайте представим обычный чайник. В него налито три литра воды. Чтобы полностью превратить три литра воды в пар на газовой плите, требуется не меньше полутора часов времени (здесь все зависит от формы чайника и мощности плиты). В трех литрах воды содержится 1026 молекул. Воздействие молекул, которые отрываются от жидкости, на саму жидкость, то это лишь тысячные доли. Именно по этой причине никто не может заметить воздействия. Кроме того, с идеально ровной поверхности любая молекула может оторваться под углом от 0 до 180 градусов, что в среднем (по теории вероятности) дает обратную силу, направленную строго вниз.
Температура — свежий пар
Температура свежего пара при регулировании мощности скользящим начальным давлением пара поддерживается постоянной и равной номинальной.
Температура свежего пара снижается, и, прежде чем поступить в турбину, этот пар возвращается в котлоагрегат и поступает во вторую ступень пароперегревателя, где его температура вновь повышается до 520 С.
Температура свежего пара перед пуском турбины должна быть на 80 — 100 С выше температуры верха па-ровпуска ЦВД, но не более 500 С; температура пара промежуточного перегрева должна иметь такое же превышение и не превосходить номинального значения.
Температура свежего пара отличается от номинальной не более чем на 100 — 120 С.
Температура свежего пара и пара после промперегрева для повышения надежности работы энергоблоков 300 МВт снижена до 540 С. Турбо-установка может работать при температуре свежего пара 560 С и температуре пара после промперегрева 565 С.
Температуру свежего пара измеряют не менее чем в трех точках, в том числе перед измерительной диафрагмой и перед стопорным клапаном.
Температуру свежего пара повышают со скоростью 1 С / мин, определяемой из условий соблюдения основных критериев надежности пуска. Для регулирования температуры включаются пусковые впрыски. При нагрузках 70 — 80 МВт и выше регулирование температуры пара осуществляется впрыском собственного конденсата. При 50 МВт включаются в работу пылесистемы и котел постепенно переводится на сжигание пыли.
| Изменение мощности турбины Т-250 / 300 — 23 5 ТМЗ в зависимости от начальной температуры пара и его расхода при двухступенчатом подогреве сетевой воды. |
Снижение температуры свежего пара таит в себе опасность охлаждения ротора и его быстрого сокращения относительно статора с возникновением задеваний.
| Изменение мощности турбины Т-250 / 300 — 23 5 ТМЗ в зависимости от начальной температуры пара и его расхода при двухступенчатом подогреве сетевой воды. |
Понижение температуры свежего пара заметно уменьшает экономичность турбоустановки, поэтому оно всегда нежелательно.
Снижение температуры свежего пара вызывает уменьшение перепада тепла Я0 и увеличение удельного расхода пара на турбину. При неизменной нагрузке давление пара в камере регулирующей ступени увеличится, а перепад тепла в ней уменьшится; перепады тепла в остальных ступенях несколько увеличатся, лопатки и диафрагмы ступеней давления в этом случае будут работать с перегрузкой, тем большей, чем больше снижение температуры пара при номинальном давлении.
Повышение температуры свежего пара сверх номинальной снижает запас прочности деталей, вызывает снижение долговечности и надежности работы турбины.
Регулирование температуры свежего пара осуществляется для каждой трубной системы раздельно при помощи двухступенчатого впрыска; величина впрыска регулируется в зависимости от нагрузки котлоагрегата и температуры пара. Регулирование температуры пара после промежуточного перегрева производится за счет изменения положения газовых заслонок на выходе из обеих шахт последнего газохода. Для поддержания определенных соотношений величин вода — топливо — воздух и для устранения появляющихся отклонений применены корректирующие регуляторы. Изменения тепловыделения в топке, обусловленные, например, колебаниями величины теплоты сгорания угля, приводят к изменениям температур в параллельных поверхностях нагрева; посредством регулятора параллельных поверхностей нагрева импульс разностей температур воздействует на изменение подачи топлива и питательной воды. Изменение подачи воды является временным для компенсации временных колебаний тепловыделения в топке; как только скажется корректировка по топливу, корректировка по подаче воды снимается.
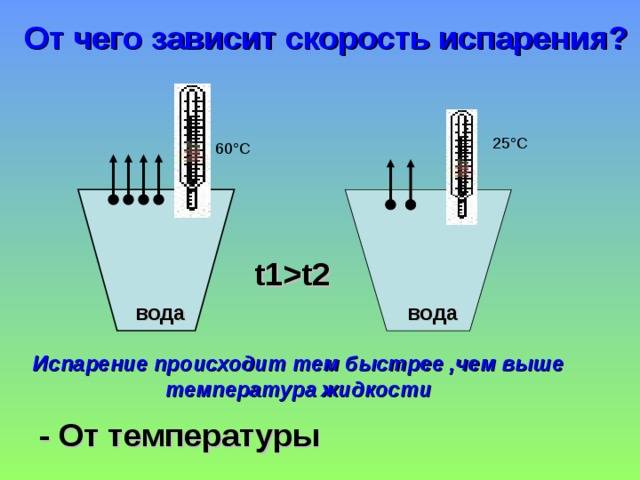
Скорость испарения и температура
В жидкостях всегда имеется некоторое число быстро движущихся молекул. Значит,
Наполним два одинаковых сосуда водой одинаковой массы. Но в один сосуд нальем воду комнатной температуры, а в другой — подогретую до высокой температуры (рисунок 3).
 Рисунок 3. Зависимость скорости испарения от температуры жидкости
Рисунок 3. Зависимость скорости испарения от температуры жидкости
Наблюдения покажут, что количество подогретой жидкости в сосуде уменьшилось быстрее, чем жидкости комнатной температуры.
При увеличении температуры жидкости, увеличивается ее внутренняя энергия. При этом увеличивается средняя кинетическая энергия молекул и средняя скорость их движения. Значит, чем выше температура жидкости, тем больше в ней быстро движущихся молекул, которыe способны вылететь с поверхности.
Например, после дождя на улице остаются лужи. Дождь может пройти и холодной осенью, и жарким летом. Когда лужи высыхают быстрее? Конечно же летом, когда на улице более высокая температура.
Какие бывают тепловые явления?
Давайте поразмышляем о том, что может происходить с телом под действием температуры. Для этого не придется идти далеко: достанем из холодильника кубик льда, опустим его в стакан и посмотрим, что получится. Спустя какое-то время лед начнет таять (или плавиться) и превратится в воду. Но на этом мы не остановимся! Перельем воду в кастрюлю и начнем нагревать на плите. Что произойдет тогда?
Абсолютно верно! Вода начнет нагреваться, а дальше — кипеть. Если вовремя не выключить плиту или не снять с нее кастрюлю, вся вода может выкипеть — превратиться в водяной пар.
За короткий промежуток времени мы смогли пронаблюдать воду в трех агрегатных состояниях: твердом, жидком и газообразном. А можно ли обратить процесс вспять и снова получить кубик льда?
Так просто это сделать не получится: должно быть, весь водяной пар разлетелся по квартире, и его будет очень сложно собрать воедино. Но это не говорит о том, что процесс перехода из одного агрегатного состояния в другое необратим.
Предположим, нам удастся добыть целый литр водяного пара. Охлаждая его, мы заметим, как пар конденсируется — превращается в капельки жидкости. А получить лед совсем просто, если поместить полученную жидкость в морозильную камеру.
Если внимательно проанализировать опыт, вы заметите, что переход из одного агрегатного состояния в другое не происходит мгновенно. Для этого необходимо нагреть или охладить вещество до определенной температуры, причем для каждого вещества эти температуры разные. Так, лед начинает таять при 0 °С, а железо плавится аж при 1 538 °С.
А как называются процессы, связанные с повышением и понижением температуры? Сколько их всего?
Начнем с самого легкого. Процессы, связанные с нагреванием или охлаждением, так и называются. Напомним, что эти процессы не ведут к изменению агрегатного состояния, а, можно сказать, являются подготовкой к нему.
Плавление — процесс перехода из твердого состояния в жидкое. А обратный процесс, когда жидкость превращается в твердое тело, называется кристаллизацией (или затвердеванием). Для этих процессов необходимо достичь одной и той же температуры вещества. То есть лед начнет плавиться при нуле градусов, но одновременно с этим вода начнет кристаллизоваться при этой температуре.
Парообразование (кипение) — процесс перехода жидкости в газ, а конденсация — обратный процесс перехода газа в жидкость. Для этих процессов также существует одна и та же температура. Ртуть кипит при температуре 356,7 °С, и при этой же температуре пары ртути превращаются в жидкость.
Отдельно выделим процесс сгорания вещества. Это явление также является тепловым, но, к сожалению, оно необратимо.
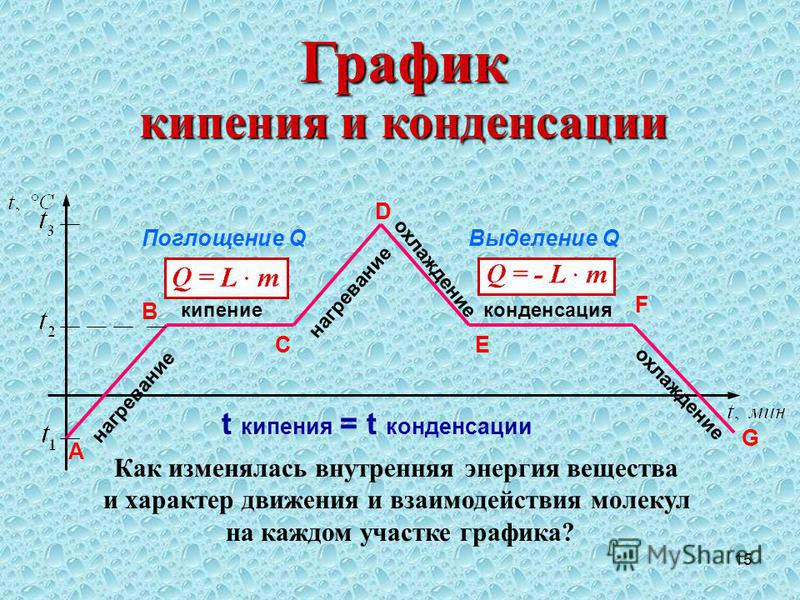
Рассмотрим график фазовых переходов для воды:
Обратите внимание на то, как одно тепловое явление сменяет другое.
Согласно графику, в начале опыта мы берем лед при температуре −40 °С и начинаем его нагревать. График этого процесса представлен наклонной прямой 1–2
Достигнув 0 °С (точка 2), лед начинает таять. Для этого процесса не нужно увеличивать температуру, достаточно 0 °С, но понадобится время, чтобы процесс завершился. Поэтому плавление льда на графике представлено прямой линией 2–3, параллельной оси абсцисс.
Мы продолжаем нагревать воду (наклонная линия графика 3–4) до 100 °С — в этой точке начинается кипение. Если мы хотим показать на графике, что процесс кипения продолжается, от точки 100 °С мы бы провели прямую линию, параллельную оси абсцисс (4–5), а нагревание водяного пара выглядело бы как наклонная линия 5–6 (схожая с подобными процессами, уже представленными на графике).
Пойдем в обратном направлении: на графике процесс 6–7 — охлаждение пара, 7–8 — конденсация, 8–9 — охлаждение жидкости, 9–10 — кристаллизация, а дальше — охлаждение твердого тела.
Итого к тепловым явлениям относятся 7 процессов: сгорание, нагревание, охлаждение, кипение (парообразование), конденсация, плавление, кристаллизация (затвердевание).
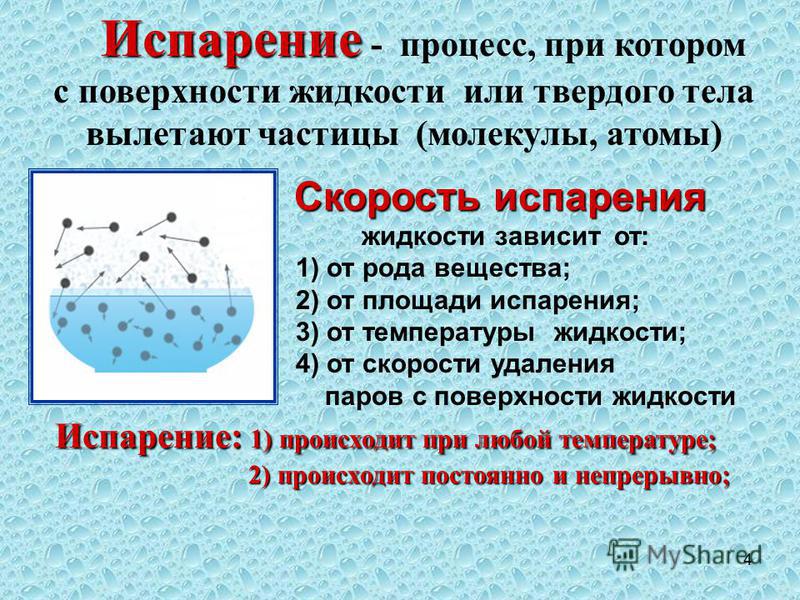
Свойства испарения
Экспериментально установлены следующие cвойства испарения:
- При одинаковых условиях различные вещества испаряются с различной скоростью (скорость испарения определяется числом молекул, переходящих в пар с поверхности вещества за 1 с).
- Скорость испарения тем больше:
- чем больше площадь свободной поверхности жидкости;
- чем меньше плотность паров над поверхностью жидкости. Скорость увеличивается при движении окружающего воздуха (ветер);
- чем больше температура жидкости.
- При испарении температура тела понижается.
Механизм испарения можно объяснить с точки зрения MKT: молекулы, находящиеся на поверхности, удерживаются силами притяжения со стороны других молекул вещества. Молекула может вылететь за пределы жидкости лишь тогда, когда ее кинетическая энергия превышает значение той работы, которую необходимо совершить, чтобы преодолеть силы молекулярного притяжения (работа выхода). Поэтому покинуть вещество могут только быстрые молекулы. В результате средняя кинетическая энергия оставшихся молекул уменьшается, а температура жидкости понижается. Для того, чтобы поддерживать температуры испаряющейся жидкости неизменной, к ней необходимо подводить некоторое количество теплоты.
Молекулы пара хаотически движутся. Поэтому некоторые из них могут снова возвратиться в жидкость. Процесс перехода вещества из газообразного состояния в жидкое называется конденсацией.
Число возвратившихся в жидкость за определенный промежуток времени молекул тем больше, чем больше концентрация молекул пара, а следовательно, чем больше давление пара над жидкостью. Конденсация пара сопровождается нагреванием жидкости. При конденсации выделяется такое же количество теплоты, которое было затрачено при испарении.
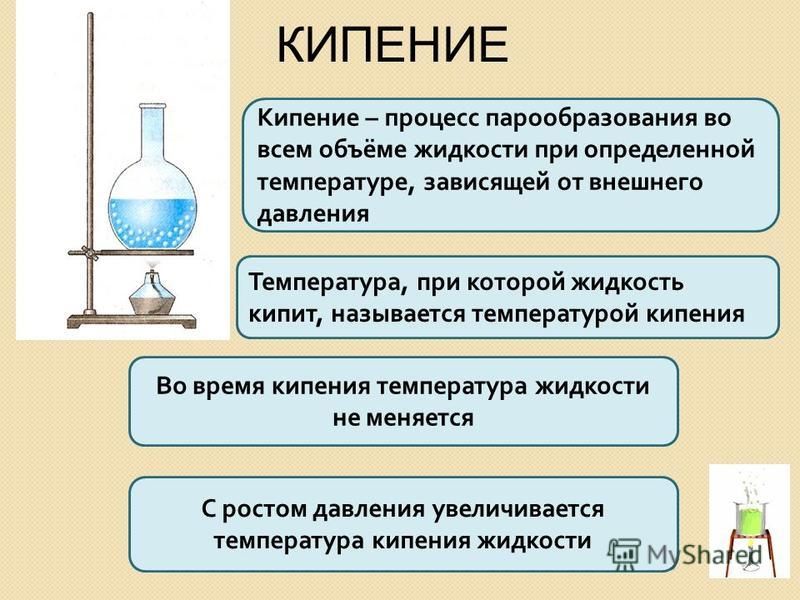
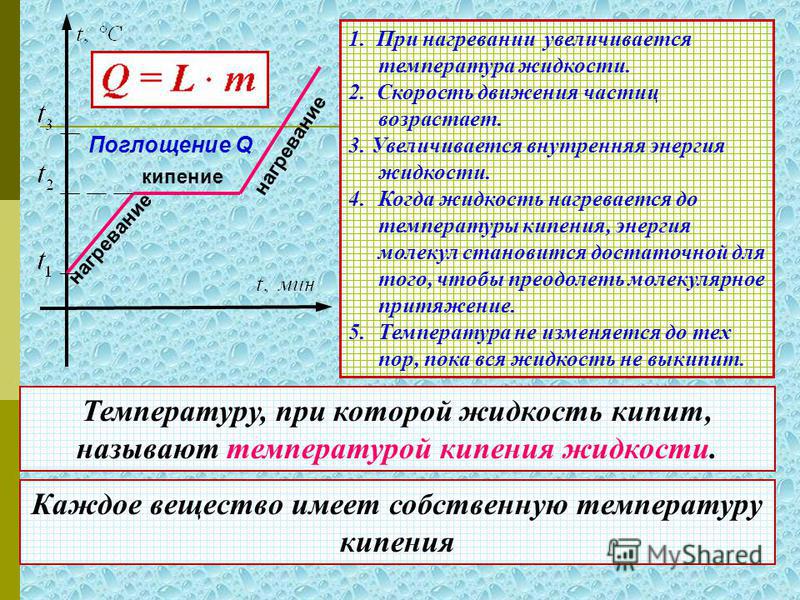
Кипение жидкостей
Кипение — это парообразование, происходящее одновременно и с поверхности, и по всему объему жидкости. Оно состоит в том, что всплывают и лопаются многочисленные пузырьки, вызывая характерное бурление.
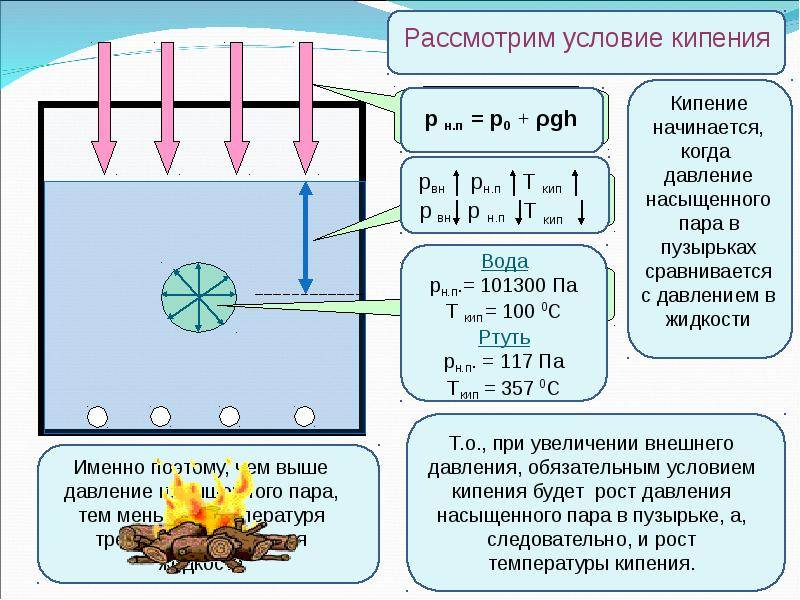
Как показывает опыт, кипение жидкости при заданном внешнем давлении начинается при вполне определенной и не изменяющейся в процессе кипения температуре и может происходить только при подводе энергии извне в результате теплообмена (рис. 3):
\(~Q = L \cdot m,\)
где L — удельная теплота парообразования при температуре кипения.

Рис. 3
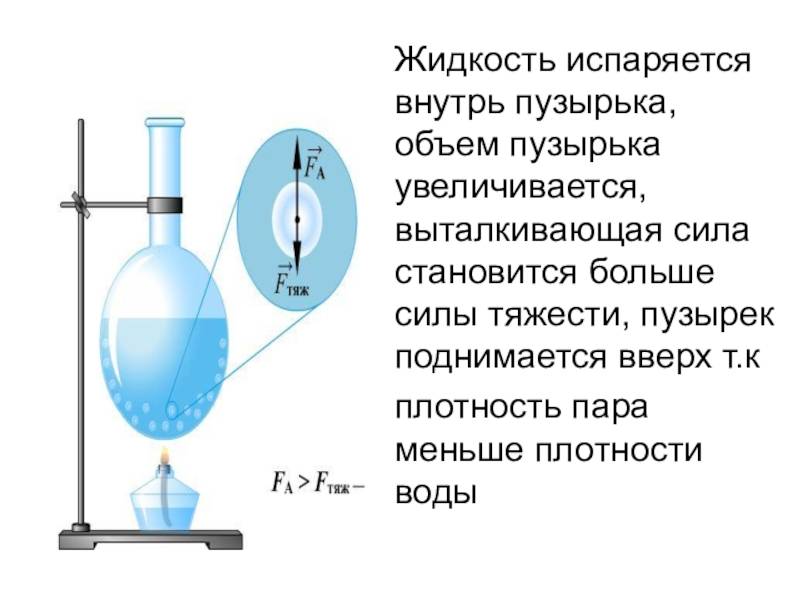
Механизм кипения: в жидкости всегда имеется растворенный газ, степень растворения которого понижается с ростом температуры. Кроме того, на стенках сосуда имеется адсорбированный газ. При нагревании жидкости снизу (рис. 4) газ начинает выделяться в виде пузырьков у стенок сосуда. В эти пузырьки происходит испарение жидкости. Поэтому в них, кроме воздуха, находится насыщенный пар, давление которого с ростом температуры быстро увеличивается, и пузырьки растут в объеме, а следовательно, увеличиваются действующие на них силы Архимеда. Когда выталкивающая сила станет больше силы тяжести пузырька, он начинает всплывать. Но пока жидкость не будет равномерно прогрета, по мере всплытия объем пузырька уменьшается (давление насыщенного пара уменьшается с понижением температуры) и, не достигнув свободной поверхности, пузырьки исчезают (захлопываются) (рис. 4, а), вот почему мы слышим характерный шум перед закипанием. Когда температура жидкости выравняется, объем пузырька при подъеме будет возрастать, так как давление насыщенного пара не изменяется, а внешнее давление на пузырек, представляющее собой сумму гидростатического давления жидкости, находящейся над пузырьком, и атмосферного, уменьшается. Пузырек достигает свободной поверхности жидкости, лопается, и насыщенный пар выходит наружу (рис. 4, б) — жидкость закипает. Давление насыщенного пара при этом в пузырьках практически равно внешнему давлению.
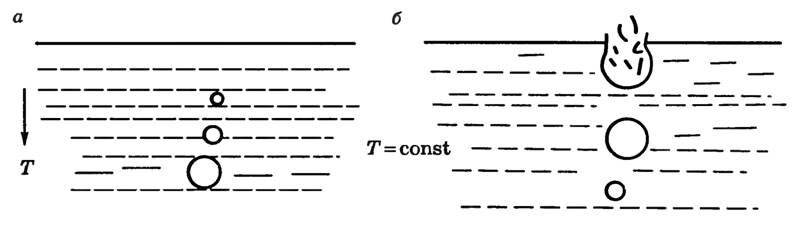
Рис. 4
Температура, при которой давление насыщенного пара жидкости равно внешнему давлению на ее свободную поверхность, называется температурой кипения жидкости.
Так как давление насыщенного пара увеличивается с ростом температуры, а при кипении оно должно быть равно внешнему, то при увеличении внешнего давления температура кипения увеличивается.
Температура кипения зависит также от наличия примесей, обычно увеличиваясь с ростом концентрации примесей.
Если предварительно освободить жидкость от растворенного в ней газа, то ее можно перегреть, т.е. нагреть выше температуры кипения. Это неустойчивое состояние жидкости. Достаточно небольших сотрясений и жидкость закипает, а ее температура сразу понижается до температуры кипения.
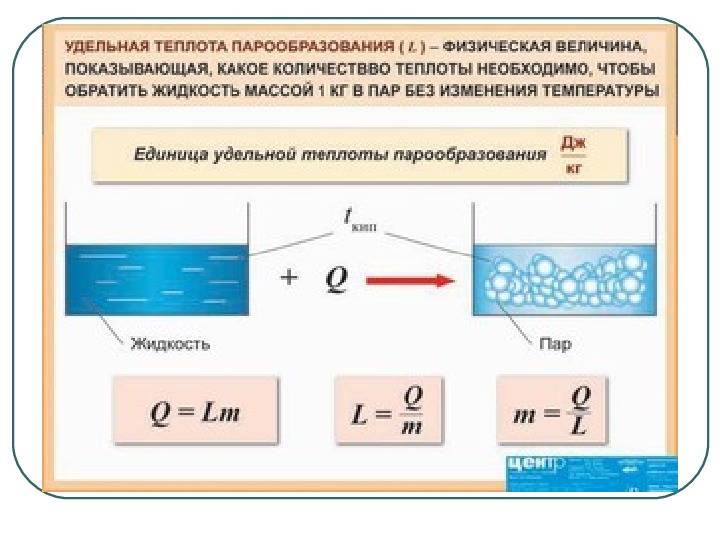
Формулы для расчета количества теплоты
Количество теплоты, которое необходимо для возникновения процесса или выделяется при нем, можно рассчитать по формулам.
Количество теплоты, необходимое для нагревания тела или выделяющееся при охлаждении
Q = cmΔt
Q — количество теплоты
c — удельная теплоемкость вещества, из которого состоит тело [Дж/(кг·°C)]
m — масса тела
Δt — изменение температуры тела
Отдельно поговорим про с — удельную теплоемкость вещества. Это табличная величина, т. е. ее значение для каждого вещества различается, оно постоянно и его можно найти в конце учебника по физике или в интернете.
Количество теплоты, необходимое для плавления или выделяющееся при кристаллизации
Q = λm
Q — количество теплоты, необходимое для плавления кристаллического тела, находящегося при температуре плавления в нормальном атмосферном давлении
m — масса тела
λ — удельная теплота плавления вещества, из которого состоит тело [Дж/кг]
Количество теплоты, необходимое для кипения или выделяющееся при конденсации
Q = Lm
Q — количество теплоты, необходимое для превращения в пар жидкости (выделяющееся при конденсации пара), находящейся при температуре кипения и нормальном атмосферном давлении
m — масса тела
L — удельная теплота парообразования жидкости [Дж/кг]
Количество теплоты, выделяющееся при полном сгорании топлива
Q = qm
Q — количество теплоты, выделяющееся при полном сгорании топлива
q — удельная теплота сгорания топлива [Дж/кг]
m — масса топлива
Как вы можете заметить, все формулы имеют одну и ту же логику: энергия Q прямо пропорциональна массе тела и удельным величинам. А значит, чем больше масса тела, тем больше энергии потребуется для его нагревания. Чем меньше тело, тем меньше энергии выделится при его остывании, и т. д.
Тепловые явления встроены в нашу жизнь на все сто процентов. Все — от кулинарии до погодных явлений, от медицины до промышленности — в той или иной мере зависит от процессов нагревания, плавления, кипения и других.
Мы можем плавить металлы и изготавливать из них различные предметы, повышать влажность воздуха, кипятить воду и выпекать булочки, изготавливать микросхемы и лекарства. Какой процесс ни возьмете, во всех можно отыскать примеры тепловых явлений.
Тепловые процессы в физике связаны между собой. Порой нагревание одного вещества влечет за собой плавление и даже кипение другого. Заинтригованы? Приходите на онлайн-уроки физики в школу Skysmart — там вы сможете детально разобраться в этом и других поразительных процессах.
Агрегатные состояния веществ
Свобода теплового движения молекул просматривается в жидкостях, так как у них нет привязки к центрам, что позволяет производить перемещения по всему объему. Этим объясняется ее текучесть.
Определение 8
Если молекулы располагаются близко, то могут образовывать упорядоченные структуры с несколькими молекулами. Данное явление получило название ближнего порядка. Дальний порядок характерен для кристаллических тел.
Расстояние в газах между молекулами намного больше, поэтому действующие силы малы, а их движения идут вдоль прямой, ожидая очередного соударения. Значение 10–8 м является средним расстоянием между молекулами воздуха в нормальных условиях. Так как взаимодействие сил слабое, газы расширяются и могут заполнять любой объем сосуда. Когда их взаимодействие стремится к нулю, то говорят о представлении идеального газа.



![§ 33. испарение жидкостей. пары [1975 ковалев п.г., хлиян м.д. - физика (молекулярная физика, электродинамика)]](https://arena-swim.ru/wp-content/uploads/2/c/c/2ccc64e4eb6595e2707a10c21736cf4c.jpeg)