Решение задачи
Уравнение Менделеева-Клапейрона удобно использовать для решения различных практических задач. Приведем пример одной из них.
Кислород массой 0,3 кг находится в баллоне объемом 0,5 м3 при температуре 300 К. Как изменится давление газа, если температуру увеличить до 400 К?
Полагая кислород в баллоне идеальным газом, воспользуемся уравнением состояния для вычисления начального давления, имеем:
Теперь вычислим давление, при котором газ будет находиться в баллоне, если поднять температуру до 400 К, получаем:
Изменение давления при нагреве составит:
Полученное значение ΔP соответствует 0,15 атмосферы.
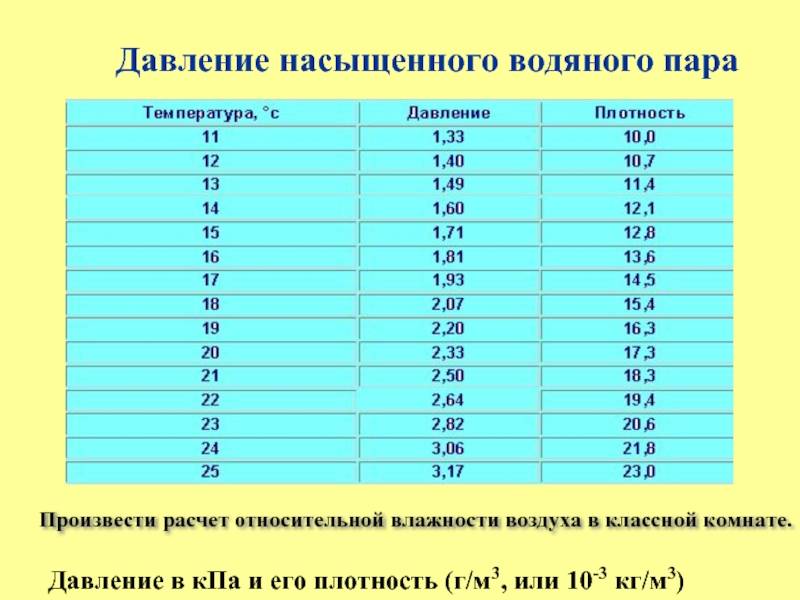
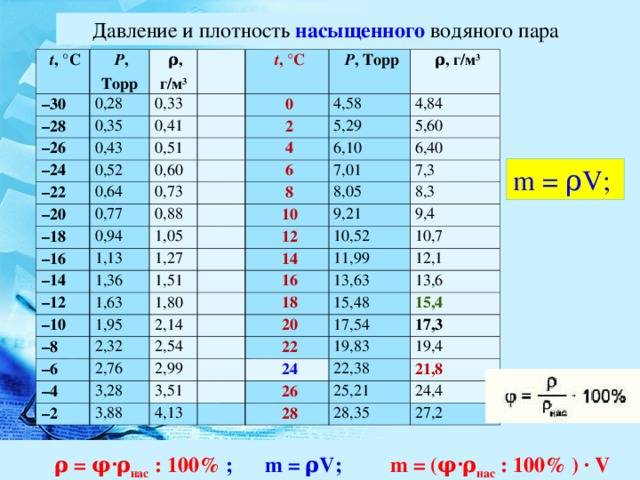
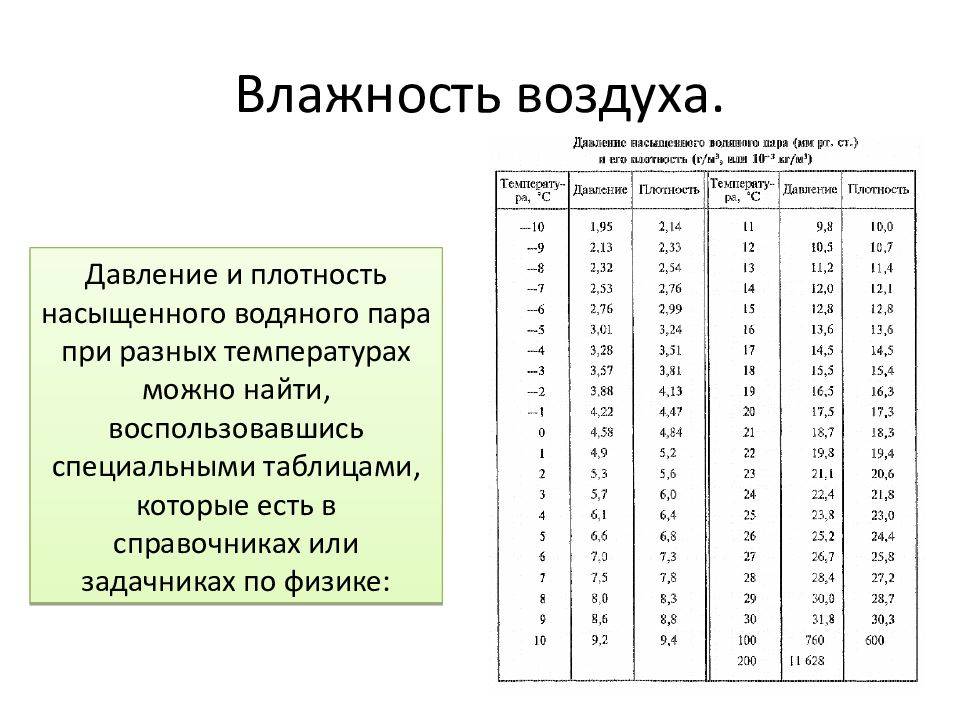
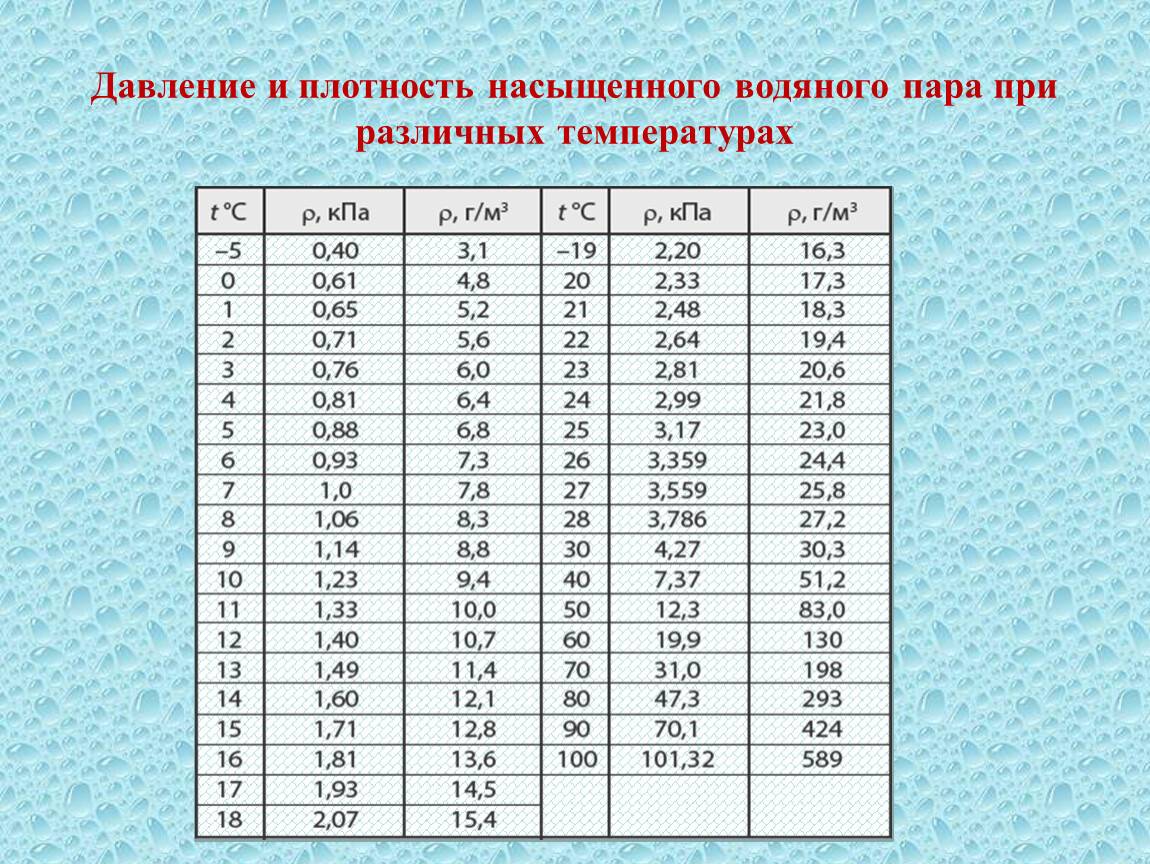
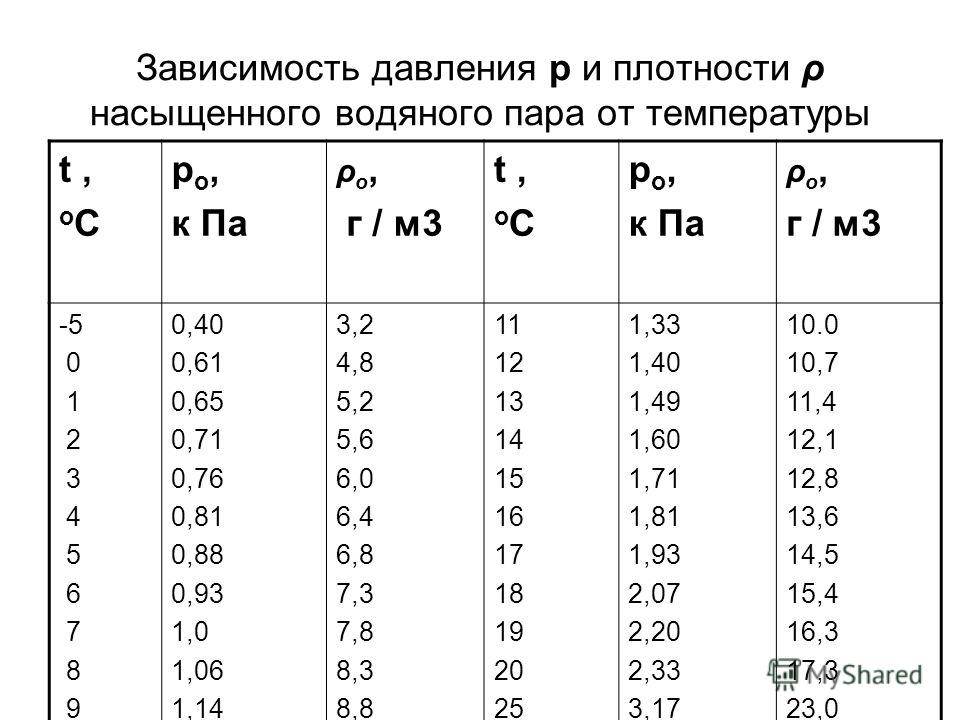
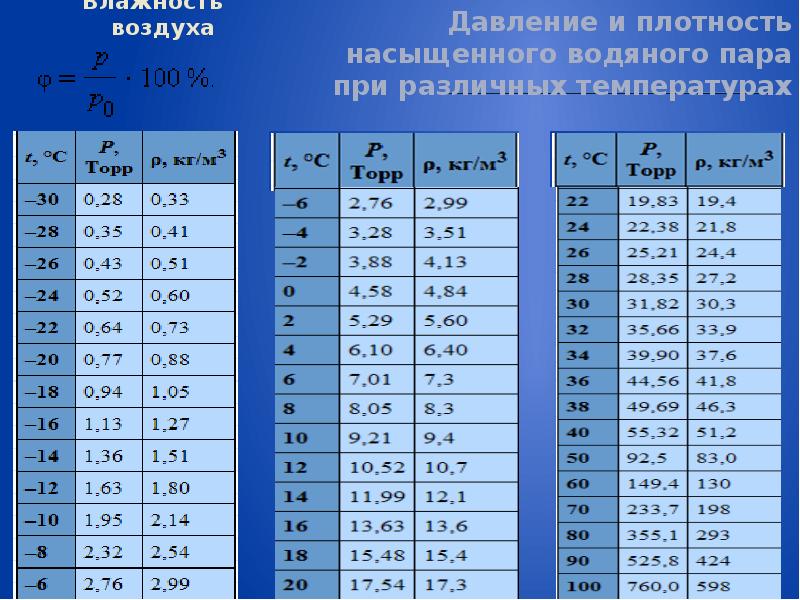
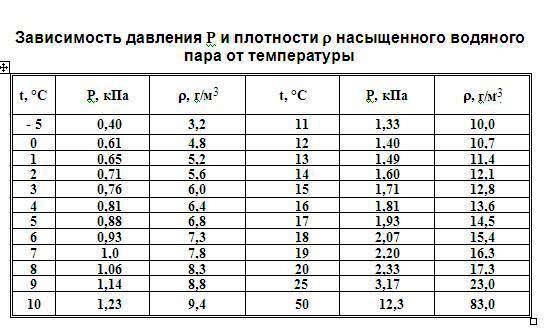
Влажность воздуха
Воздух, содержащий водяной пар, называется влажным.Чем больше пара находится в воздухе, тем выше влажность воздуха.
Абсолютная влажность — это парциальное давление водяного пара, находящегося в воздухе (т. е. давление, которое водяной пар оказывал бы сам по себе, в отсутствие других газов). Иногда абсолютной влажностью называют также плотность водяного пара в воздухе.
Относительная влажность воздуха — это отношение парциального давления водяного пара в нём к давлению насыщенного водяного пара при той же температуре. Как правило, это отношение выражают в процентах:
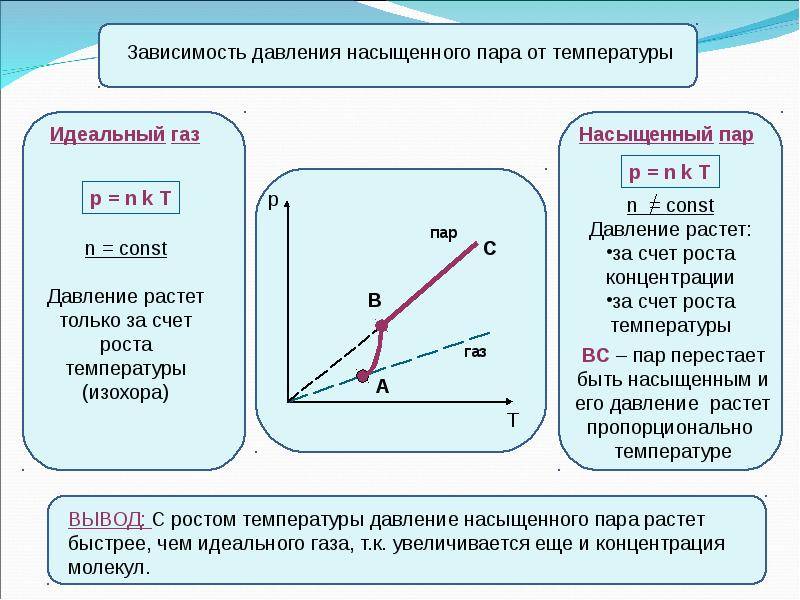
Из уравнения Менделеева-Клапейрона (1) следует, что отношение давлений пара равно отношению плотностей. Так как само уравнение (1) , напомним, описывает насыщенный пар лишь приближённо, мы имеем приближённое соотношение:
Одним из приборов, измеряющих влажность воздуха, является психрометр. Он включает в себя два термометра, резервуар одного из которых завёрнут в мокрую ткань. Чем ниже влажность, тем интенсивнее идёт испарение воды из ткани, тем сильнее охлаждается резервуар «мокрого» термометра, и тем больше разность его показаний и показаний сухого термометра. По этой разности с помощью специальной психрометрической таблицы определяют влажность воздуха.
Динамическое равновесие
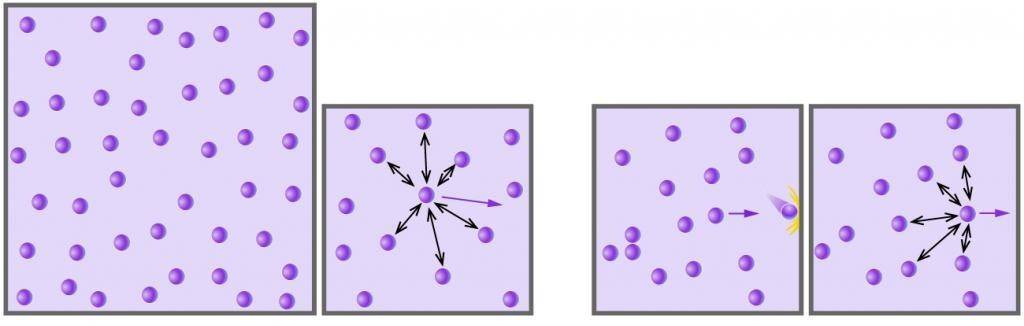
А что будет, если сосуд с жидкостью герметично закрыть? Плотность пара над поверхностью жидкости начнёт увеличиваться; частицы пара будут всё сильнее мешать другим молекулам жидкости вылетать наружу, и скорость испарения станет уменьшаться. Одновременно начнёт увеличиваться скорость конденсации, так как с возрастанием концентрации пара число молекул, возвращающихся в жидкость, будет становиться всё больше.
Наконец, в какой-то момент скорость конденсации окажется равна скорости испарения. Наступит динамическое равновесие между жидкостью и паром: за единицу времени из жидкости будет вылетать столько же молекул, сколько возвращается в неё из пара. Начиная с этого момента количество жидкости перестанет убывать, а количество пара — увеличиваться; пар достигнет «насыщения».
Насыщенный пар — это пар, который находится в состоянии динамического равновесия со своей жидкостью. Пар, не достигший состояния динамического равновесия с жидкостью, называется ненасыщенным.
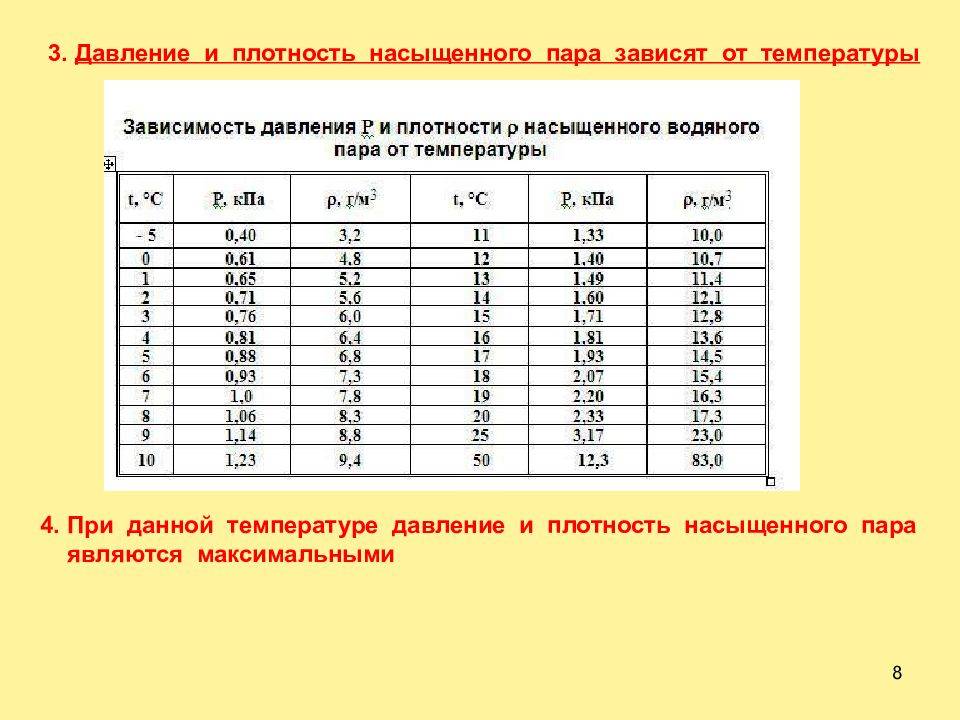
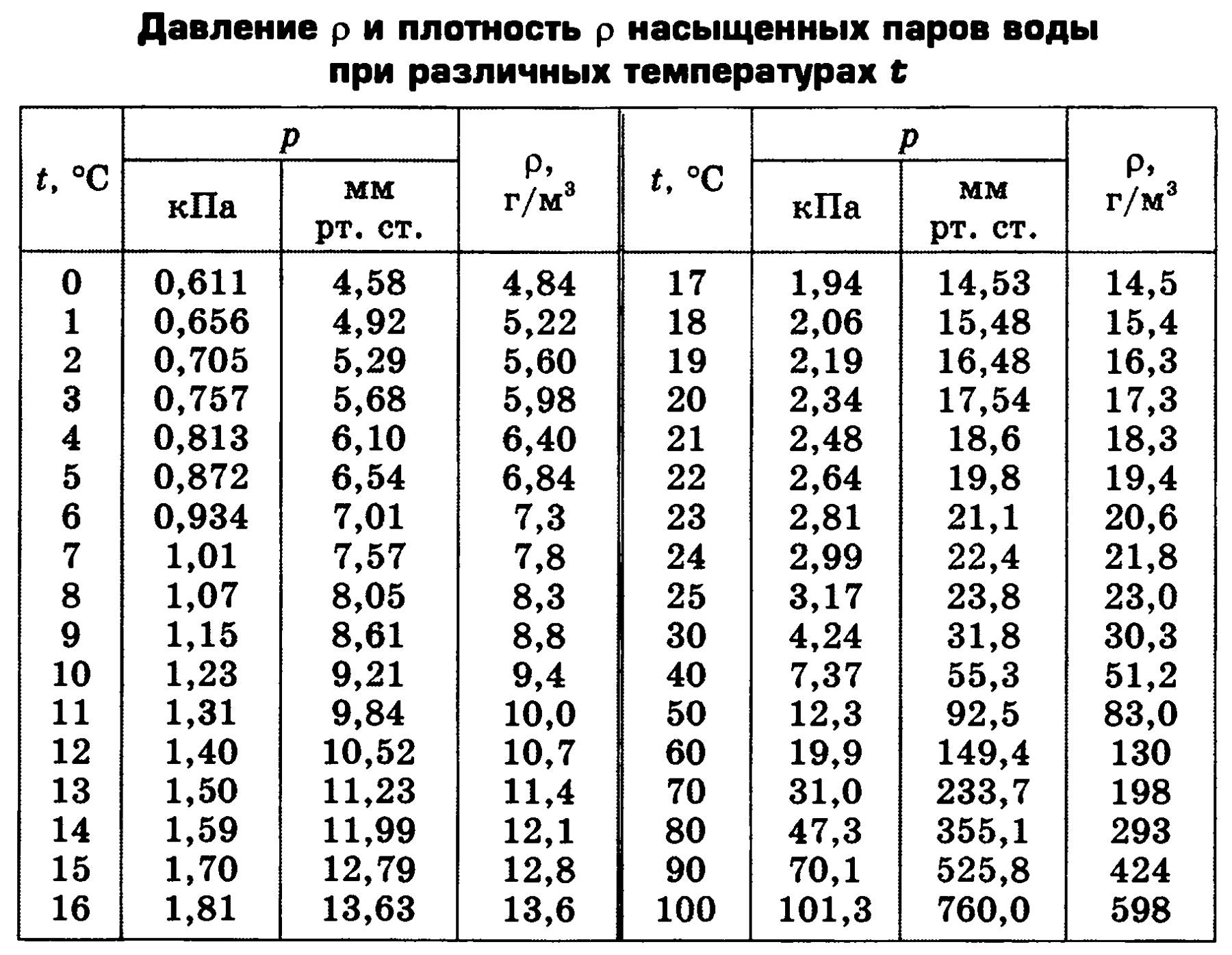
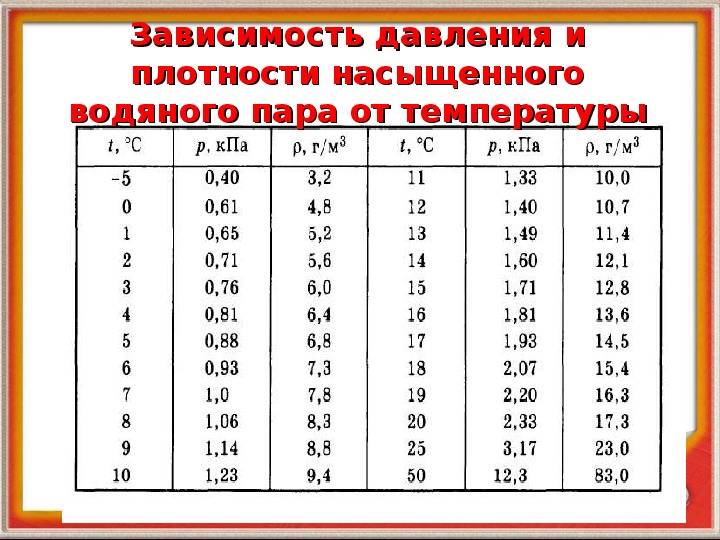
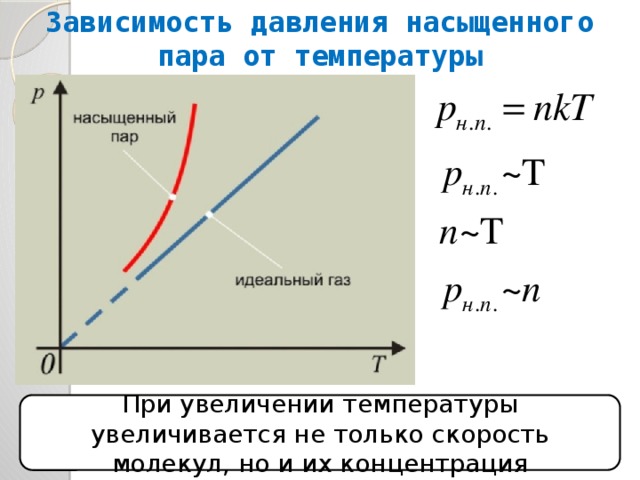
Давление и плотность насыщенного пара обозначаются и . Очевидно, и — это максимальные давление и плотность, которые может иметь пар при данной температуре. Иными словами, давление и плотность насыщенного пара всегда превышают давление и плотность ненасыщенного пара.
Какой пар называется насыщенным
Итак, молекулы все время вылетают из вещества и возвращаются обратно. Если вылетает больше молекул, чем возвращается, жидкость испаряется. Если, наоборот, больше молекул возвращается, чем вылетает, значит происходит конденсация. Если же число вылетающих молекул равно числу возвращающихся, то устанавливается так называемое динамическое (подвижное) равновесие между веществом и паром. Пар, находящийся в равновесии с жидкостью (веществом), называется насыщенным паром.
 Рис. 2. Динамическое равновесие жидкости и пара
Рис. 2. Динамическое равновесие жидкости и пара
Насыщенный пар, содержащий капельки жидкости, называется влажным, а не содержащий — сухим. Состояние сухого пара неустойчиво: при малейшем отводе теплоты он частично конденсируется и становится влажным, а при подводе тепла превращается в перегретый пар.
Состояние динамического равновесия для воды при комнатной температуре достигается, когда за 1 секунду жидкость покидают и возвращаются обратно 1022 молекул с 1 см2 поверхности воды.
Когда скорость испарения превышает скорость конденсации, пар называется ненасыщенным, а динамическое равновесие при этом отсутствует.
Изотермический процесс (T=const)
Определение 10
При протекании квазипроцесса с постоянным параметром Т говорят об изотермическом процессе.
Из уравнения pV=νRT=mMRT имеем, что неизменные температура Т с количеством вещества ν – это постоянное состояние для произведения значения давления газа p на его объем V:
pV=const.
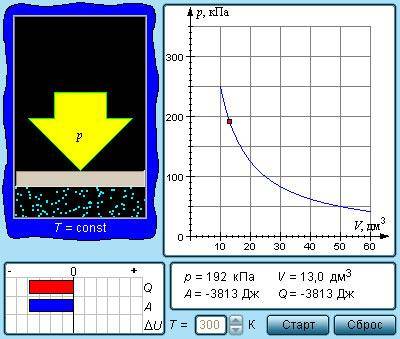
Рисунок 3.3.1. Модель изотермического процесса.
Определение 11
Изображение изотермических процессов на плоскости (p, V) предусматривает различные значения температур Т гипербол p~1V. Они получили название изотермов.
Коэффициент пропорциональности данного отношения увеличивается с ростом Т. Рисунок 3.3.2 показывает, что при меньшей Т подразумевает уменьшение V. В 1662 году было получено уравнение изотермического процесса Р. Бойлем, а позднее Э. Мариоттом в 1676 году. Отсюда и сложное его название – закон Бойля-Мариотта.
Рисунок 3.3.2. Семейство изотерм на плоскости (p, V). T3>T2>T1.
Свойство – насыщенный пар
Свойства насыщенных паров дифенила и дифенилоксида приведены в виде диаграмм на рис. 63а и 636, где даны температура, давление, скрытая теплота испарения и теплосодержание.
Свойства насыщенного пара () можно считать просто предельными значениями свойств в области перегрева, если давление равно давлению насыщенного пара при данной температуре или температура равна температуре кипения при рассматриваемом давлении. Подобным же образом свойства насыщенной жидкости () являются предельными значениями для жидкой области, если жидкость находится при температуре кипения. Из уравнения ( 43) очевидно, что сухость пара в области двух фаз на диаграмме равна расстоянию по горизонтали от, данной точки до кривой жидкости, деленному на общее расстояние по горизонтали между двумя пограничными кривыми. Это служит основой для проведения линии постоянной сухости пара на такой диаграмме.
Изучая свойства насыщенного пара, мы установили ( § 293), что каждой температуре при обычных условиях соответствуют определенные плотность и давление насыщенного пара.
Эти свойства насыщенных паров низкокипящих жидкостей положены в основу работы паровых манометрических термсметров. Однако шкала термометров этого типа является неравномерной, так как изменение давления паров с изменением температуры неравномерно ( см. фиг.
Большие отклонения свойств насыщенных паров многих жидкостей от свойств идеального газа приводят к тому, что их давление описывают с помощью различных эмпирических соотношений.
В вакуум-паровой системе использовано свойство насыщенного пара снижать температуру при понижении его давления. Возможность поддержания температуры ниже 100 С на поверхностях нагревательных приборов объясняется созданием в системе вакуума ( давления меньше атмосферного) при помощи вакуум-насоса, отсасывающего конденсат из системы и нагнетающего его в котел.
| Растворимость воды в жидких фреонах ( / по весу.| Свойства насыщенных паров фреона-11. |
В табл. 6 приведены свойства насыщенных паров фреона-11, а на фиг.
Свойства перегретого пара значительно отличаются от свойств насыщенного пара. Чем больше сптюиг перегрева, тем ближе свойства перегретого пара к свойствам идеального газа Отклонение этих свойств объясняется конечными объемами молекул пара и наличием сил взаимодействия ыс-жду ними.
Свойства перегретого пара сильно отличаются от свойств насыщенного пара.
Свойства перегретого пара резко отличаются от свойств насыщенного пара и приближаются к свойствам газов.
Обсуждаются экспериментальные изотермы и область двухфазных состояний: Описываются свойства насыщенного пара и динамический характер равновесия пар – жидкость. Рассматриваются свойства вещества в критическом состоянии. Обсуждаются скрытая теплота перехода и общая характеристика фазовых переходов первого рода.
Свойства перегретого пара ( точка d, рис. 1.16) существенно отличаются от свойств насыщенного пара.
Этот основной недостаток парового отопления исключается в так называемой вакуум-паровой системе, в которой использовано свойство насыщенного пара, заключающееся в том, что его температура снижается при понижении давления. В этой системе давление снижается ниже атмосферного при помощи вакуум-насоса, которым конденсат отсасывается из системы и перекачивается в котел. В результате снижения давления температура пара в приборах вакуум-паровой системы поддерживается в пределах 60 – 90 С.
Следует рассмотреть также и изменения энтропии, внутренней энергии и теплоемкости при адсорбции пара, потому что свойства насыщенного пара зависят от температуры.
Определение насыщенного пара
Оставим стакан воды на столе и будем замерять уровень воды в нем каждый день. Если записать эти измерения и сравнить их, станет очевидно: уровень воды стал меньше, то есть вода испарилась.
Теперь давайте накроем стакан сверху. Молекулы пара уже не смогут покидать пространство над жидкостью, по мере испарения их количество начнет расти, а значит, будет расти и количество молекул, которые конденсируются в единицу времени.
Сначала количество конденсирующихся молекул за единицу времени будет меньше количества испаряющихся молекул. Но по мере роста концентрации пара (то есть увеличении количества молекул в единице объема пара) поток конденсирующихся молекул вырастет. Это приведет к состоянию, которое называется динамическим равновесием.
Пар, находящейся в динамическом равновесии, называют насыщенным.
Представьте себе огромный бизнес-центр с не менее огромными дверями. У сотрудников бизнес-центра разный график работы, поэтому люди одновременно заходят в здание и выходят из него в произвольном количестве. Допустим, в 6 часов вечера 100 человек заходят в здание, чтобы попасть на деловую встречу, а другие 100 человек уже закончили работать и идут домой. Количество заходящих в бизнес-центр и выходящих из него будет одинаковым — это и есть состояние насыщения.
Значение давления насыщенного пара и его плотности являются максимальными при заданном значении температуры. Если это не так, то пар ненасыщенный.
Газы реальные и идеальные

Газовое состояние материи представляет собой одно из существующих четырех агрегатных состояний вещества. Примерами чистых газов являются водород и кислород. Газы могут смешиваться друг с другом в произвольных пропорциях. Всем известный пример смеси – воздух. Названные газы являются реальными, однако при определенных условиях они могут считаться идеальными. Идеальным считается газ, который соответствует следующим характеристикам:
- Частицы, образующие его, не взаимодействуют друг с другом.
- Столкновения между отдельными частицами и между частицами и стенками сосудов носят абсолютно упругий характер, то есть количество движения и кинетическая энергия до и после столкновения сохраняется.
- Частицы не обладают объемом, но имеют некоторую массу.
Все реальные газы при температурах порядка и выше комнатной (больше 300 К) и при давлениях порядка и ниже одной атмосферы (105 Па) можно считать идеальными.
Изобарный процесс (p=const)
Определение 15
Изобарный процесс – это квазистатический процесс, протекающий с постоянным параметром p.
Уравнение такого состояния с неизменным количеством вещества ν запишется как
VT=const или V=VαT, где V – объем газа при температуре °C. Температурный коэффициент объемного расширения газов равняется α=1273,15К-1.
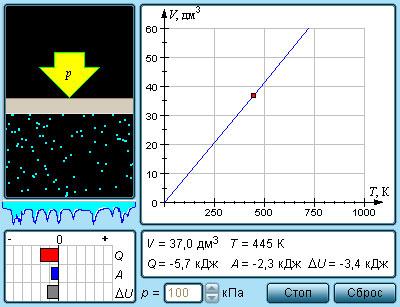
Рисунок 3.3.5. Модель изобарного процесса.
Изобарные процессы плоскости (V, T) имеют разные значения p и изображены прямыми линиями (изобарами), изображенными на рисунке 3.3.6.
Рисунок 3.3.6. Семейство изобар на плоскости (V, T). p3>p2>p1.
Определение 16
Данное уравнение с зависимостью параметра V от T с неизменным давлением довелось исследовать Ж. Гей-Люссаку в 1862 году. Оно получило название закона Гей-Люссака.
Законы Бойла-Мариотта, Шарля и Гей-Люссака объясняются с помощью молекулярно-кинетической теории газов, так как являются следствиями уравнения состояния идеального газа.
Всё ещё сложно?
Наши эксперты помогут разобраться
Все услуги
Решение задач
от 1 дня / от 150 р.
Курсовая работа
от 5 дней / от 1800 р.
Реферат
от 1 дня / от 700 р.
Уравнение состояния Менделеева-Клапейрона
Запишем сразу это уравнение, а затем объясним его значение. Это уравнение имеет следующий общий вид:
Произведение давления на объем идеального газа является пропорциональным произведению количества вещества в системе на абсолютную температуру. Коэффициент пропорциональности R называется универсальной газовой постоянной. Ее значение равно 8,314 Дж/(моль*К). Физический смысл величины R заключается в том, что она равна работе, которую совершает при расширении 1 моль газа в случае его нагрева на 1 К.
Записанное выражение также называется уравнением состояния идеального газа
Его важность состоит в том, что оно не зависит от химического типа частиц газа. Так, это могут быть молекулы кислорода, атомы гелия или вообще газовая воздушная смесь, для всех этих веществ будет справедливо рассматриваемое уравнение
Оно может быть записано в других формах. Приведем их:
Здесь m – масса газа, ρ – его плотность, M – молярная масса, N – число частиц в системе, kB – постоянная Больцмана. В зависимости от условия задачи можно использовать любую форму записи уравнения.
Библиография
ГОСТ Р 8.563–96. ГСИ. Методики выполнения измерений.
МИ 2451–98. ГСИ. Паровые системы теплоснабжения. Уравнения измерения тепловой энергии и количества теплоносителя.
ГСССД 98–2000. Вода. Удельный объем и энтальпия при температурах 0…1000 °С и давлениях 0,001…1000 МПа.
Правила учета тепловой энергии и теплоносителя. Издание Минтопэнерго Российской Федерации, М., 1995.
ГОСТ 8.207–76. ГСИ. Прямые измерения с многократными наблюдениями. Методы обработки результатов наблюдений. Основные положения.
ГОСТ 6709–72. Реактивы. Вода дистиллированная. Технические условия
Формула (2) получена из приведенного в уравнения для энтальпии насыщенного водяного пара:
h = h1(1–X) + h2X .
Формулу (7) получают, принимая в формуле (6) С=1,0000 ккал/кг×°С. При этом допускают систематическую методическую погрешность dСм = – 0,14 %, которой в дальнейших расчетах пренебрегают ввиду её малости в соответствии с РД50–453–84.
Время прогрева в каждом конкретном случае определяют экспериментально до получения однородной среды на выходе пароотводной трубки. При последующих измерениях время прогрева поддерживают постоянным, контролируя его с помощью секундомера.
* Промах (грубая погрешность измерений) – погрешность результата отдельного измерения, входящего в ряд измерений, которая для данных условий резко отличается от остальных результатов этого ряда (РМГ 29–99 ГСИ. Метрология. Основные термины и определения)
Упрощенные формулы получены при практически реализуемом условии f » 1, что позволяет считать f + 1 » 2 и f×j » j . Погрешность расчета коэффициентов a и b по упрощенным формулам (18) по сравнению с расчетом по (17) не более 10%.
Указанные пределы определены для диапазона избыточного давления пара (1,5…12) кгс/см2 при условии, что значения h1 и h2 для подстановки в формулу (3) находят по данным приложения В не пользуясь линейной интерполяцией
Расчет степени насыщенности и удельного объёма водяного пара
Задача 37.
Водяной пар при атмосферном давлении имеет температуру t = 126,09 С. Определить степень его насыщенности и удельный объем.Решение:
По таблицам теплофизических свойств водяного пара находим, что температуре t = 126,09 С соответствует давление насыщения Рн = 2,4 . 10-5 Па. По формуле: = Рi/Рн, где
ф – степень насыщенности; Рi – давление водяного пара, 101325 Па; Рн – давление насыщенного пара при заданной температуре.
Тогда
= (1,01325 . 10-5)/(2,4 . 10-5) = 0,422.
Удельный объем пара рассчитаем по формуле:
Рi . vi = Ri. T, где
Ri – газовая постоянная водяного пара, равная 461,58 Дж/(кг . К); T – температура пара, К.
Тогда
vi = (Ri. T)/Рi = /(1,01325 . 10-5) = 1,818 м3/кг.
Ответ: = 0,422; vi = 1,818 м3/кг.