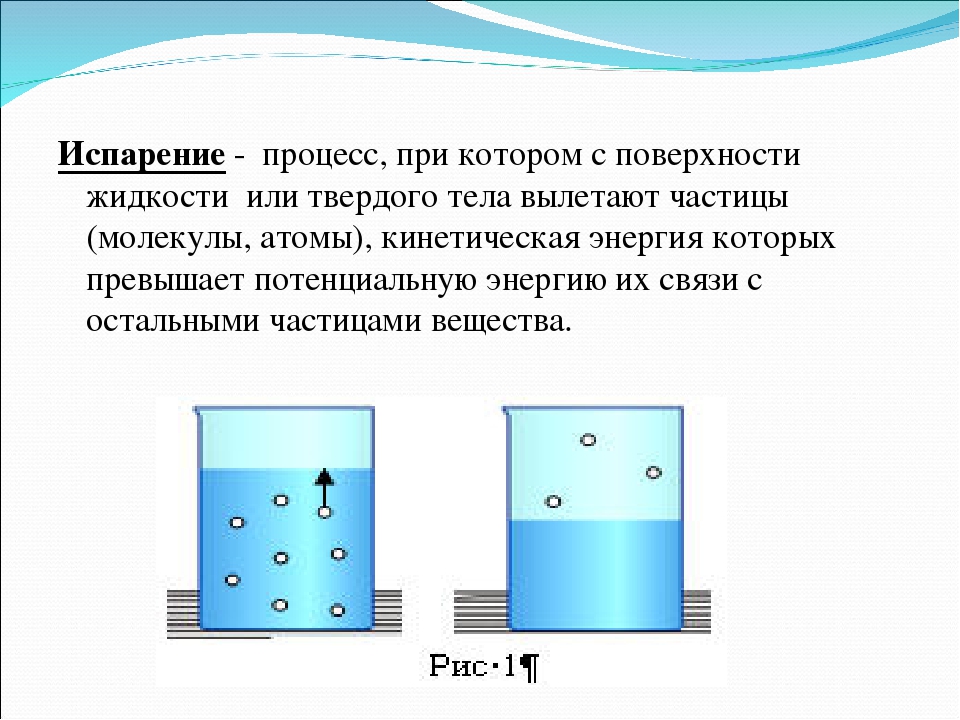
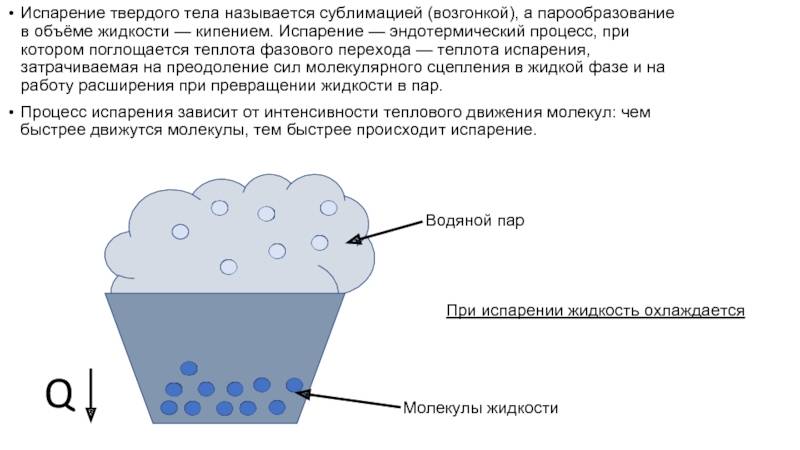
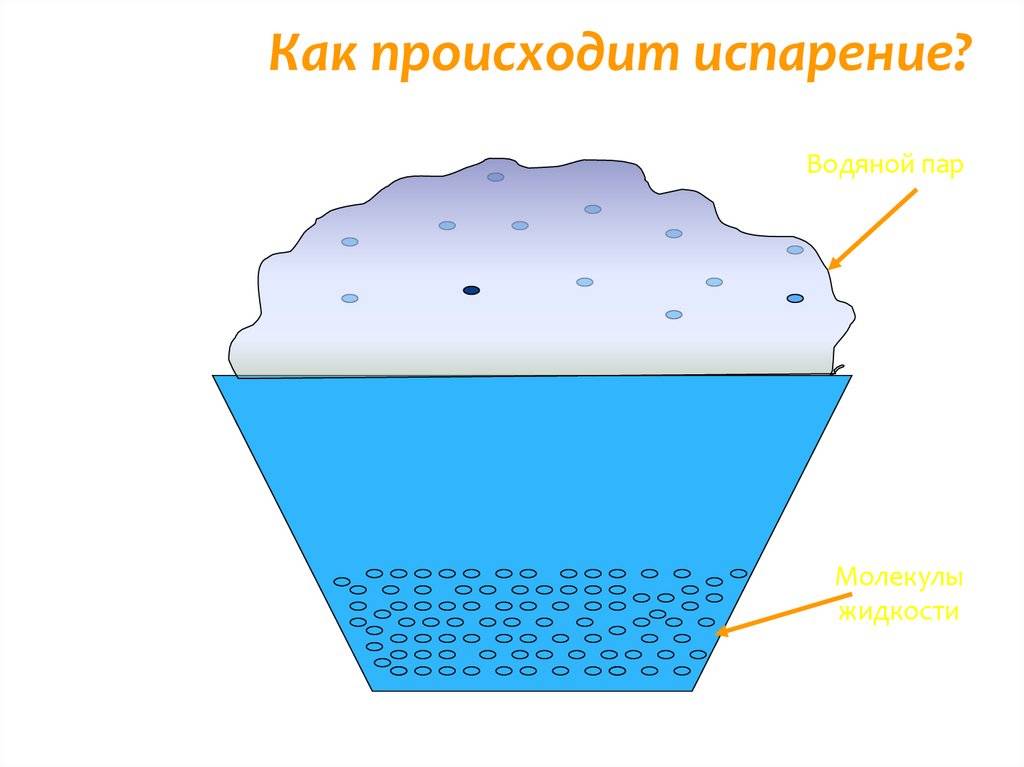
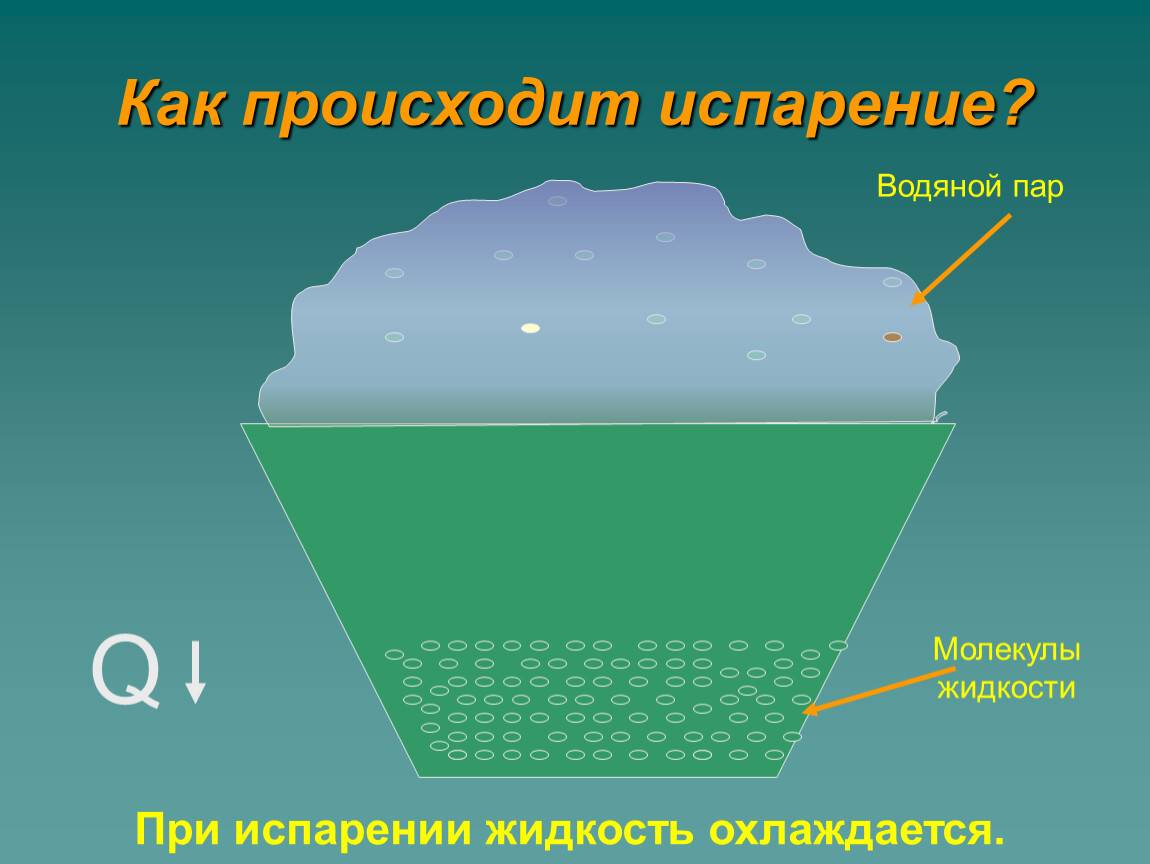
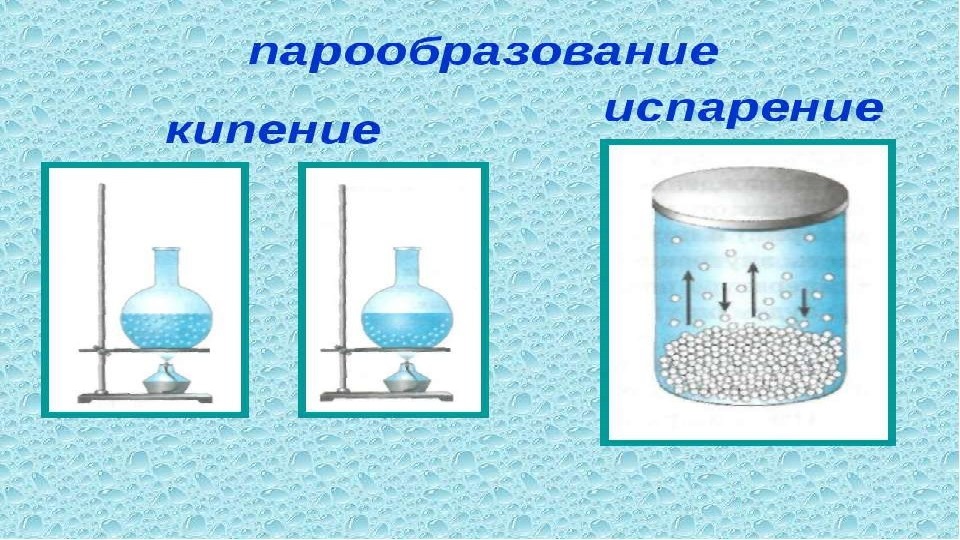
Температура — испарение — вода
Первый период сушки начинается тогда, когда образовавшийся из влаги пар проникает через всю толщу бумажного полотна и уходит наружу. Этот период ( участок ВС) характеризуется удалением свободной влаги из бумажного полотна. Он идет с постоянной скоростью испарения со всей поверхности бумажного полотна при практически постоянной температуре, равной температуре испарения воды при данных барометрических условиях ( / м не более 100 С), независимо от температуры поверхности сушильных цилиндров. Продолжительность первого периода сушки длится 50 — 65 % от общей продолжительности сушки бумаги.
Имеются разнообразные конструкции опреснителей по способу дистилляции, в особенности за рубежом, где этот способ широко распространен. Испарители бывают с естественной и искусственной циркуляцией воды, вертикальные и горизонтальные, работающие с давлением пара ниже атмосферного ( вакуумные испарители) и выше атмосферного. Вакуумные испарители, в которых вакуум создается термокомпрессором, применяют с целью избежания образования накипи, так как в них температура испарения воды снижается до 55 С. Борьба с накипеобразованием является основной проблемой при опреснении воды дистилляцией.
Полное удаление воды при обезвоживании смолы является трудной операцией, что необходимо учитывать при получении прозрачных литых фенопластов. Процесс обезвоживания связан с дальнейшей конденсацией продуктов реакции, сопровождающейся выделением воды и повышением вязкости. В связи с этим необходимо, с одной стороны, несколько задерживать скорость конденсации, а с другой — понизить температуру испарения воды, остающуюся же воду диспергировать в частицах смолы. Для этой цели рекомендуется в конце процесса обезвоживания добавлять органические растворители, дающие азеотропические смеси с водой.
Все вышеупомянутые влияния, приписываемые влаге, за исключением действия ее на аммиачные воды и на аммиак, могут быть нейтрализованы или, наоборот, усилены изменением скорости нагревания до конечной температуры коксования во время или после предварительной термической обработки угля. Данные Уоррена показывают, например, что выходы газа, дегтя и кокса почти целиком определяются скоростью нагревания угля в предпластическом состоянии. Из предшествовавшего рассмотрения кажется вероятным, что предварительное нагревание и высушивание угля вне коксовой печи должны являться средством для снижения скорости нагревания при температурах от 100 до верхнего предела термической обработки и что в интервале от этого предела до конечной температуры выдачи кокса уменьшение времени коксования происходит исключительно за счет устранения длительного периода, в течение которого уголь находится при температуре испарения воды. Однако возможной представляется и такая схема предварительного нагревания угля, при которой скорость нагревания его в этом интервале от 100 до верхнего предела термической обработки может оказаться большей, чем нормальная скорость в коксовой печи. Здесь необходимо привести краткое резюме результатов рассмотрения вопроса о действии скорости нагревания на процесс коксования с целью возможной оценки значения для коксования предварительного нагревания угля.
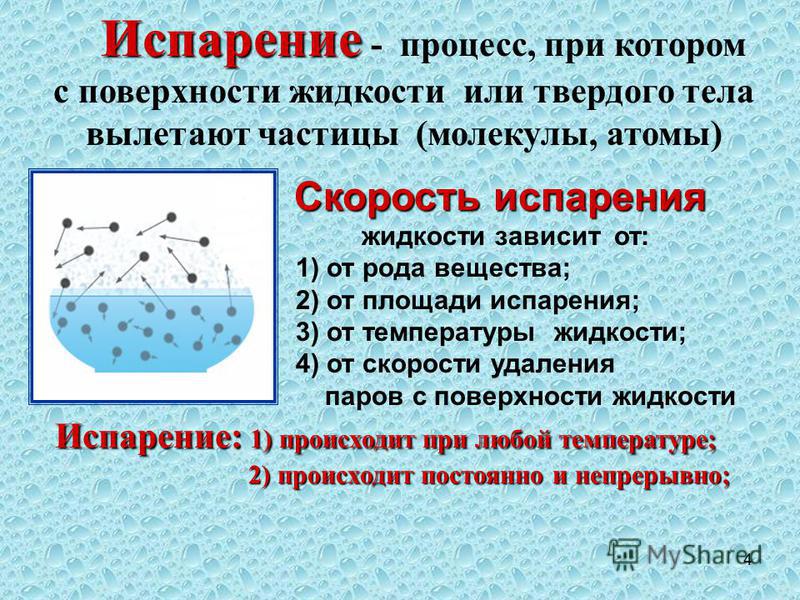
Факторы, влияющие на скорость процесса
Учёные заметили, что процесс происходит по-разному при изменяющихся свойствах жидкости и условиях внешней среды. Они выделили основные факторы, влияющие на испарение:
- Химические и физические свойства вещества, его тип и класс. Большое значение имеет его плотность — чем ближе расположены молекулы, тем труднее им преодолеть общее притяжение и оторваться, вырвавшись в газовую среду. Из-за этого свойства спирты и алкоголь улетучиваются гораздо быстрее, чем обычная вода.
- Температура. В отличие от кипения, испарение происходит при минусовых показателях термометра, но она всё ещё влияет на его скорость. При повышении температуры частицы двигаются быстрее, при понижении — медленнее. Соответственно, увеличивается или уменьшается их шанс покинуть жидкую среду и перейти в газообразную. Из-за испарительного охлаждения естественная скорость процесса со временем снижается, если нет дополнительного нагревания.
- Размеры поверхности. Зависимость объясняется тем, что чем обширнее площадь соприкосновения у жидкой и газовой среды, тем больше молекул перелетят из одной в другую. Роль играет также обратная конденсация молекул — если налить их в ёмкость с узким горлышком, пар будет оседать на её стенках и стекать обратно в толщу воды. Эту особенность явления часто эксплуатируют при охлаждении различных веществ в промышленности и бытовых целях.
- Скорость ветра. Движение воздуха «сдувает» молекулы с поверхности, увеличивая их кинетическую энергию, а также передвигает саму воду, увеличивая площадь поверхности за счёт ряби, волн, слетевших капелек и струй. Потому наличие ветра делает испарение более интенсивным. Это можно легко заметить, подув на ложку с горячей водой или чаем — так он остынет гораздо быстрее.
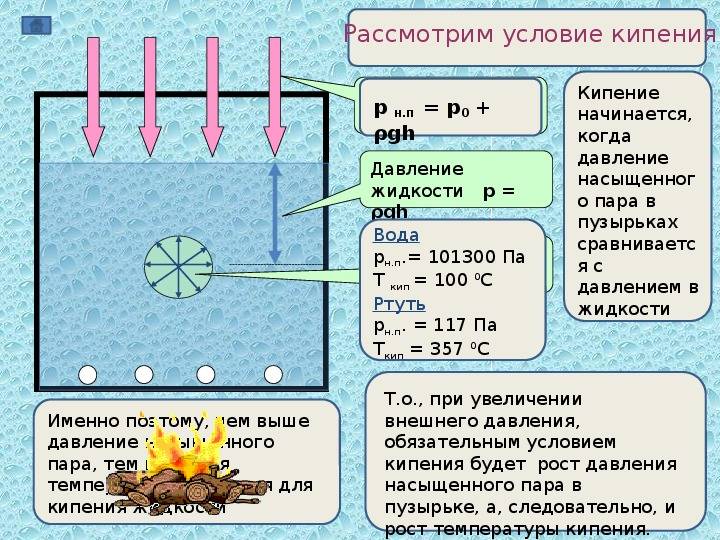
- Атмосферное давление. Чем оно ниже, тем быстрее жидкости испаряются. Показатель влияет и на температуру кипения — например, при показателе барометра в 0,5 АТМ вместо стандартного 1 вода закипает при 82 °C. В природе это явление можно наблюдать, если отправиться в горы.
Парциальное давление
Атмосферный воздух состоит из водяного пара и смеси различных газов. Давление, которое производил бы только водяной пар, при исключении всех других элементов называют парциальным давлением (упругостью).
Формула для расчета. Закон парциальных давлений газов (Закон Дальтона)
Давление смеси идеальных газов равно сумме парциальных давлений, входящих в нее газов.
Где p1, p2, p3+pn – парциальное давления, производимое каждым газом, входящим в состав смеси.
Значение выражается в мбар или мм. ртутного столба. Отвечает за влажность воздуха, атмосферное давление.
Атмосферное давление важный показатель, который напрямую влияет на влажность воздуха, состояние людей (метеозависимых), температуру кипения.
Например, в горах при подъеме над поверхностью Земли, температура кипения воды падает, так как снижается атмосферное давление. На Эльбрусе, самой высокой вершине Европы (5642), вода закипит при 80,8 °С.
Температура
Чем выше температура воздуха, тем больше водяного пара содержится в нем.
В 1 м 3 воздуха при температуре +20 °С может содержаться 17 грамм
При Температуре -20 °С – только 1 грамм.
Масса водяного пара
Массу можно определить из уравнения Менделеева-Клапейрона.
pV = (m/M . RT), где
р — давление насыщенного водяного пара;
V – его объём;
М — молярная масса пара;
R — газовая постоянная;
Т — температура пара.
Как образуется водяной пар
Образуется двумя способами, в результате испарения и кипения. Рассмотрим более подробно каждый из них.
- Испарение. Пар поступает в атмосферу, испаряясь с поверхности водоемов, почвы, растений. В атмосфере конденсация водяного пара приводит к образованию облаков, тумана и осадков, а десублимация – снега;
- Кипение. Пар образуется по всему объему жидкости.
Испарение происходит при любой температуре, кипение — при одной, определенной для текущего давления. Когда процесс кипения начался, то, несмотря на продолжающийся подвод тепла, температура жидкости изменяется незначительно, пока вся жидкость не превратится в пар.
Испарение в организме человека, в животных и растениях
Испарение играет важную роль процессе саморегуляции температуры тела человека, как впрочем, и почти всех млекопитающих. Так как чрезмерный перегрев тела вредный, а порой и смертельный (так при температуре тела более 42,2 °C в крови человека происходит свертывание белка, что приводит к смерти) организм имеет защитный механизм для предотвращения перегрева – потоотделение. Например, когда мы болеем и имеем высокую температуру, а потом она падает, мы обильно потеем. Также мы потеем при тяжелом физическом труде, при перегреве на Солнце. Пот выделяется через поры кожи, а затем испаряется, все это позволяет нашему организму быстро избавиться от лишней энергии, охладить тело и нормализировать температуру.
Аналогично это работает и у животных, а некоторые порой даже стремятся ускорить процесс испарения. Так, например собаки для этой цели в жаркую погоду открывают рот и высовывают язык. Именно гортань и язык собаки наиболее подходят для испарения влаги и охлаждения тела животного.

Что же касается растений, то и они обладают схожим механизмом. Во избежание перегрева на Солнце они запускают процесс испарения ранее поглощенной воды, таким образом, охлаждаясь
Именно поэтому очень важно в жаркую погоду усиленно поливать культурные растения, предотвращая их выгорание или засыхание, ведь в такие дни влага особенно нужна растениями не только для питания, но и для охлаждения
Книги про планирование рабочего времени
- Дэвид Аллен «Как привести дела в порядок. Искусство продуктивности без стресса»
Книга написана простым языком, легко читается и объясняет основы тайм-менеджмента, рассказывает про планирование рабочего времени. Даются четкие указания относительно того, сколько времени можно выделить на работу и отдых, как разобраться с вещами, засоряющими и облегчающими жизнь. Воды и лирики минимум, все по делу. Автор описывает не только классические методы планирования рабочего времени, но и дает проверенные на своем опыте советы.
- Глеб Архангельский «Тайм-драйв: как успевать жить и работать»
В книге классические методы тайм-менеджмента адаптированы к нашей действительности, даются жизненные примеры и практические задачи для того, чтобы постичь науку управления временем. Книга поможет вам научиться успевать больше и посвящать время только близким вам вопросам. Это книга основана на российском опыте. Книга читается очень просто, потому что написана простым языком и пронизана хорошим юмором.
- Тимоти Феррис «Как работать по 4 часа в неделю и при этом не торчать в офисе «от звонка до звонка», жить где угодно и богатеть»
Мы часто слышим о том, что нужно жить здесь и сейчас, не откладывая на завтра. Так и есть, но все же по факту получается так, что каждый строит свое будущее и жертвует при этом настоящим. Так как наслаждаться жизнью сейчас? Ответ на этот вопрос пытается дать автор книги. Он делится своим опытом того, как он отказался от «синдрома отложенной жизни». Автор утверждает, что грамотное планирование рабочего времени, – это путь к свободе. Тимоти Феррис большую часть времени путешествует. Свобода передвижения, действий, распоряжения своими средствами, которые только увеличиваются, ведь их владелец работает… целых четыре часа в неделю.
- Алан Лакейн «Искусство успевать»
Если вы изучаете тайм-менеджмент, обязательно прочтите эту книгу. На труд Алана Лакейна ссылаются многие авторы в своих работах, а это о многом говорит. Книга рассказывает об основах науки управления временем, а также об инструментах, помогающих нам «подружиться» со временем. Помимо этого, приведены интересные жизненные примеры.
- Реджина Лидс «Полный порядок. Понедельный план борьбы с хаосом на работе, дома и в голове»
Если вы не любите читать теорию и хотите сразу заняться практикой, эта книга для вас. За неделю нужно выполнить два задания, описанные автором. Первое нужно сделать на работе, а второе – дома. Пройдя обучение, вы сможете наладить отношения с близкими, навести порядок во всех аспектах жизни, а также разобрать завал на рабочем столе.
Вот и подошла к концу наша статья о планировании рабочего времени. Искренне надеемся, что вы смогли найти в ней полезные идеи для своего бизнеса. Не исключено, что какие-то мысли стали для вас открытием, а что-то оказалось просто интересным фактом, расширившим понимание процесса сложных продаж. Какие из представленных моментов вам захотелось применить на практике? Насколько вы довольны тем, как идет ваш бизнес? Проанализируйте свои ответы на эти вопросы, тогда наша статья сможет оставить существенный след в вашем сознании.
До новых встреч!
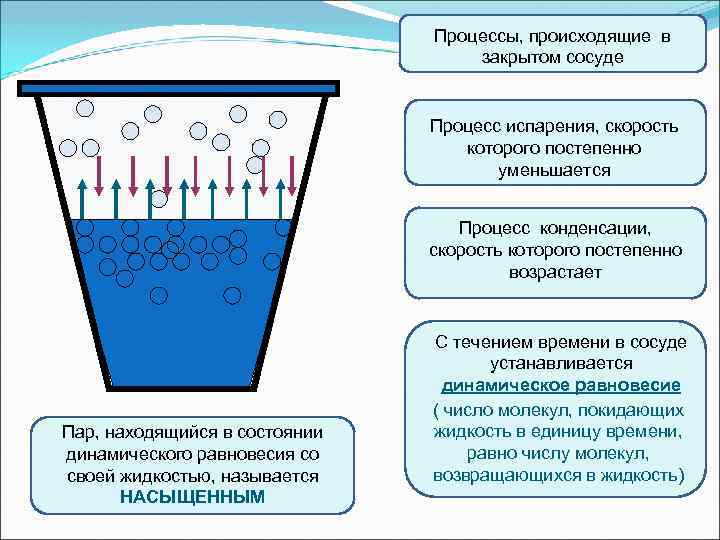
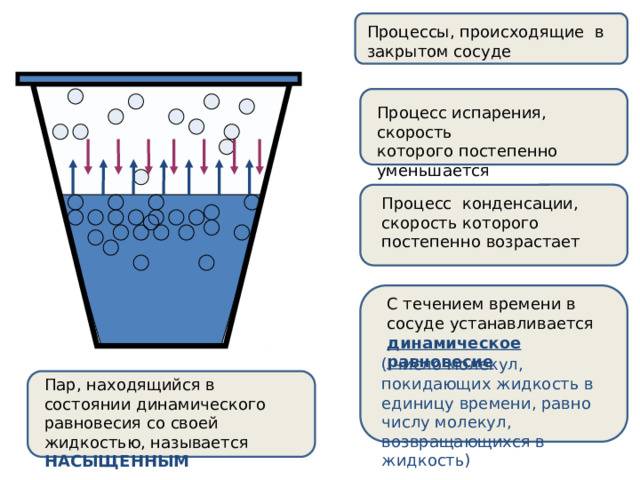
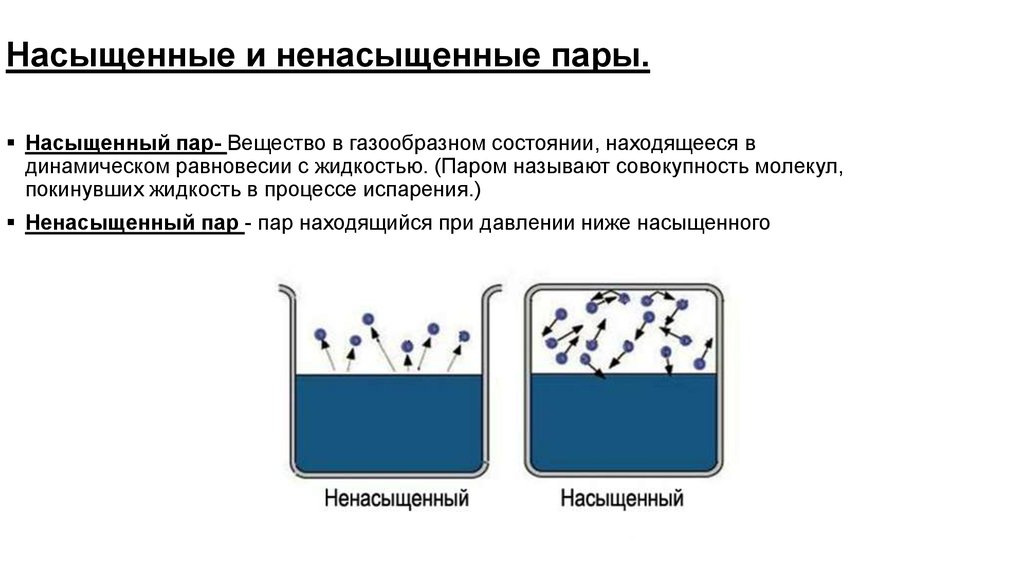
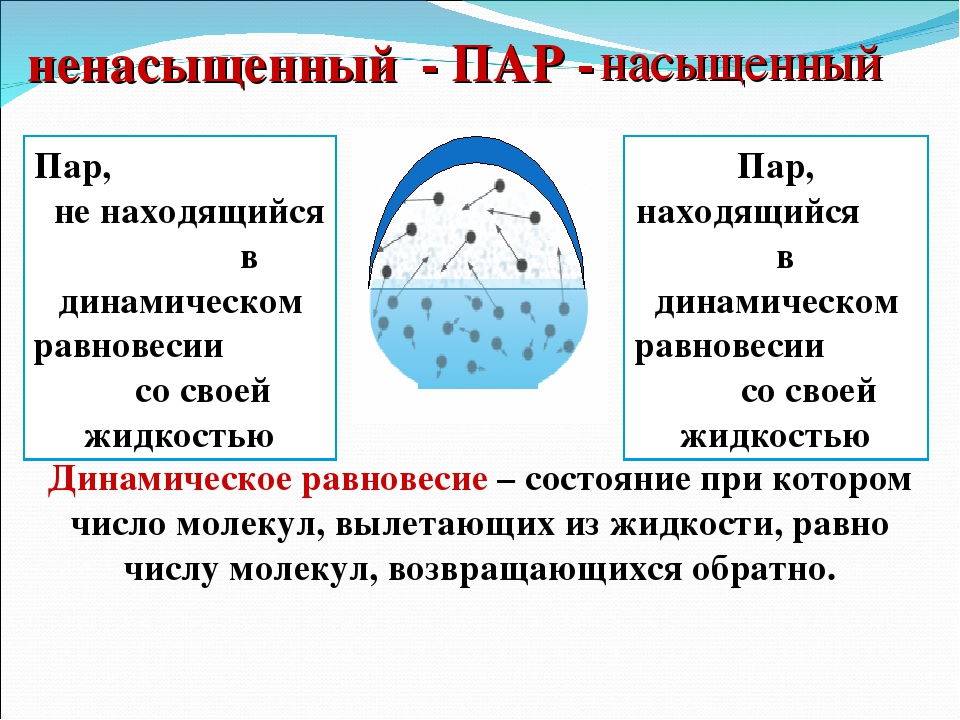
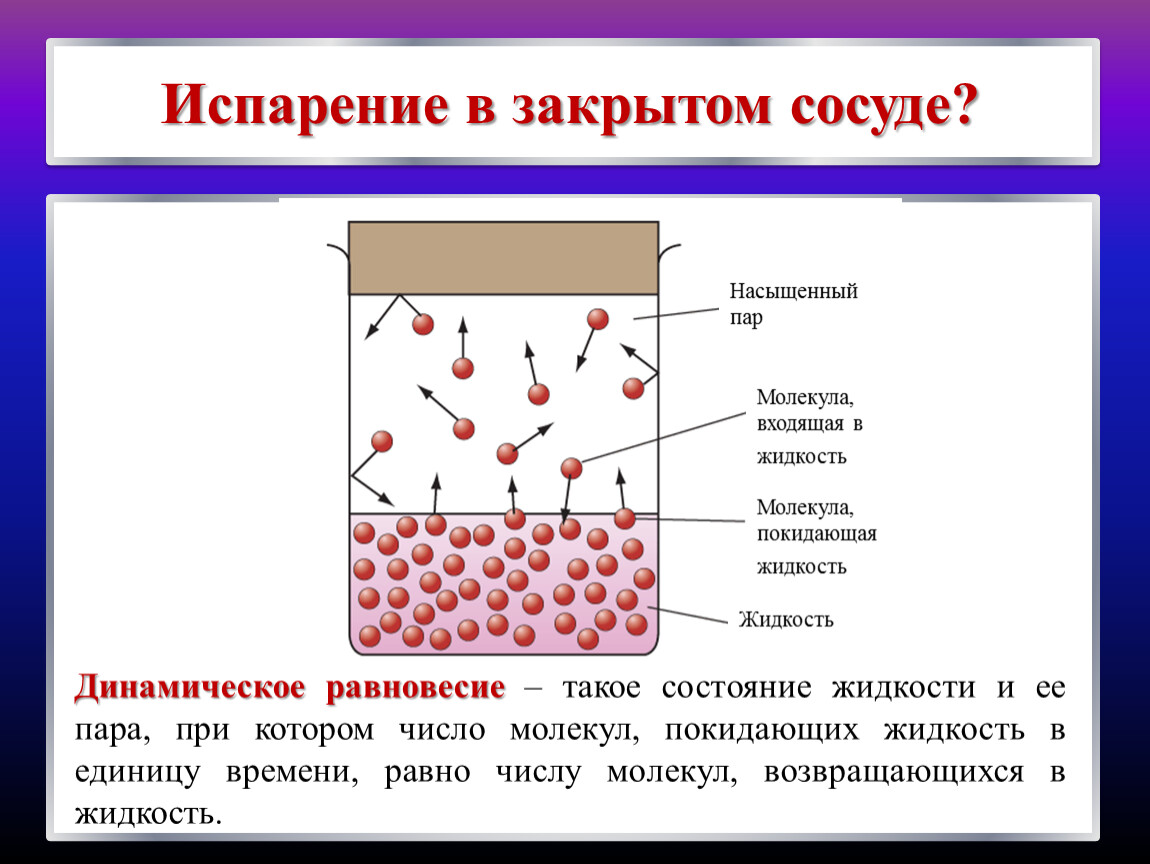
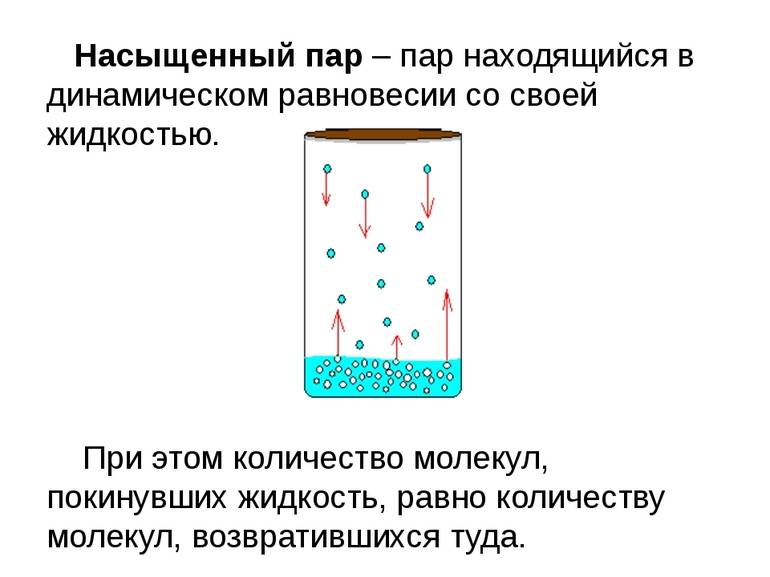
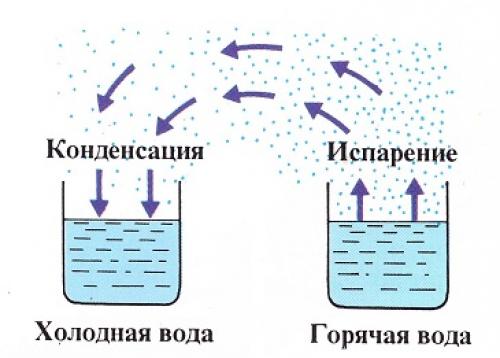
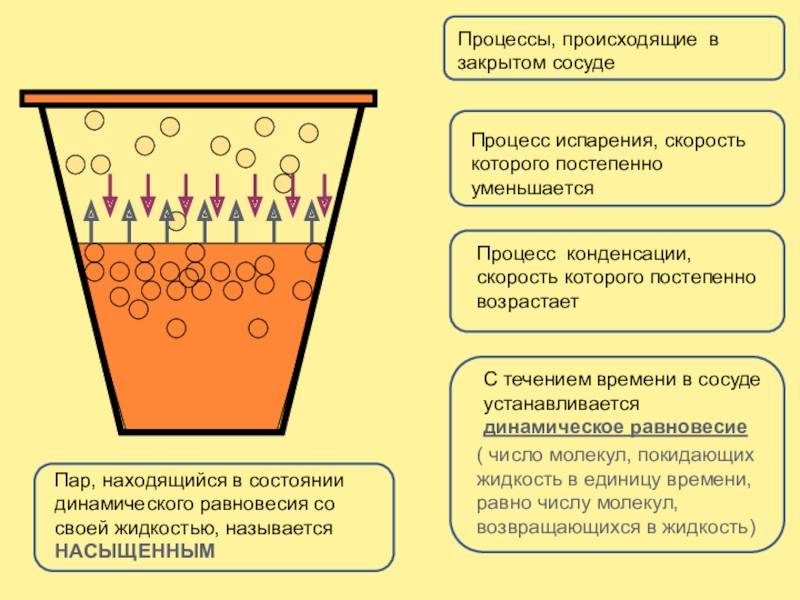
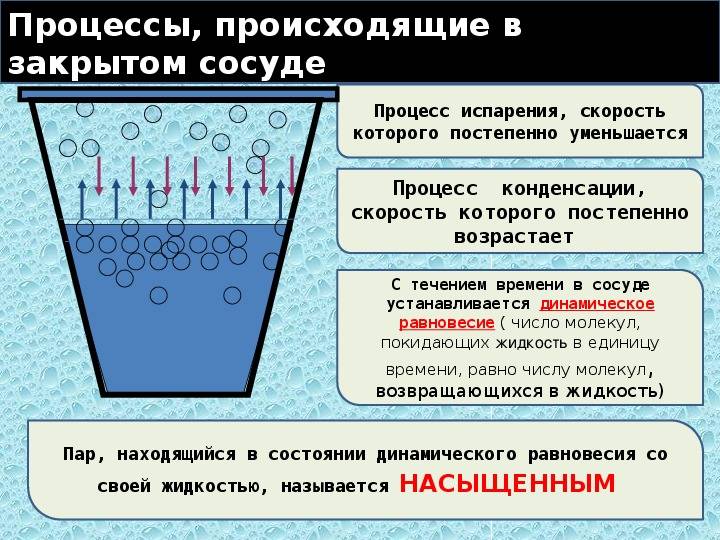
Динамическое равновесие
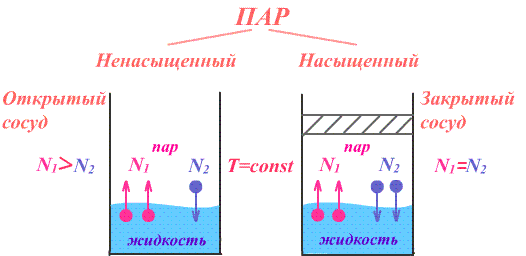
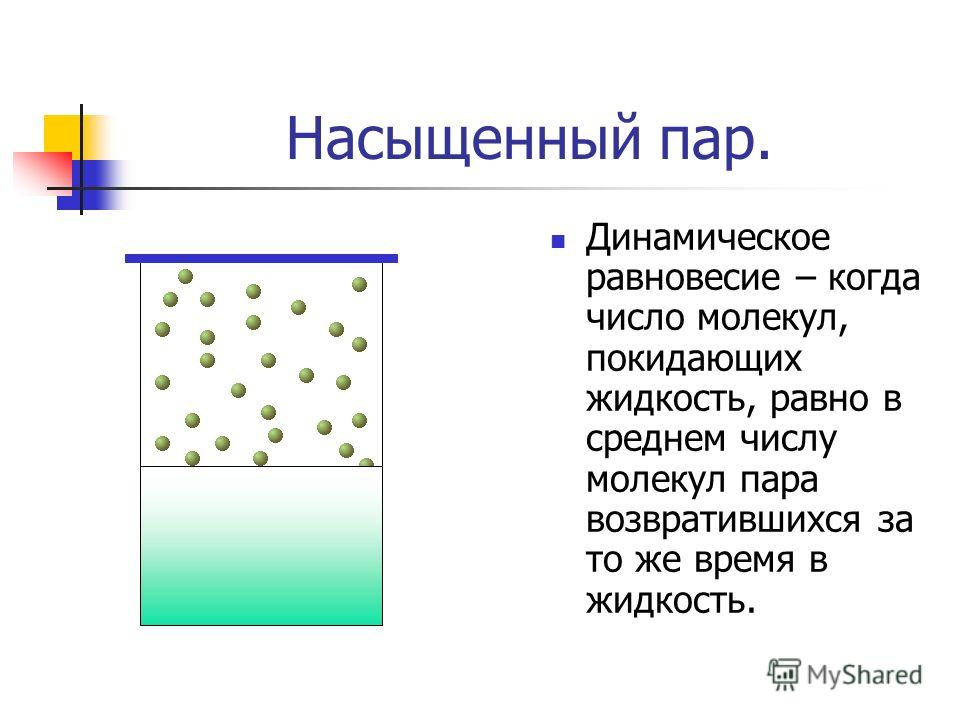
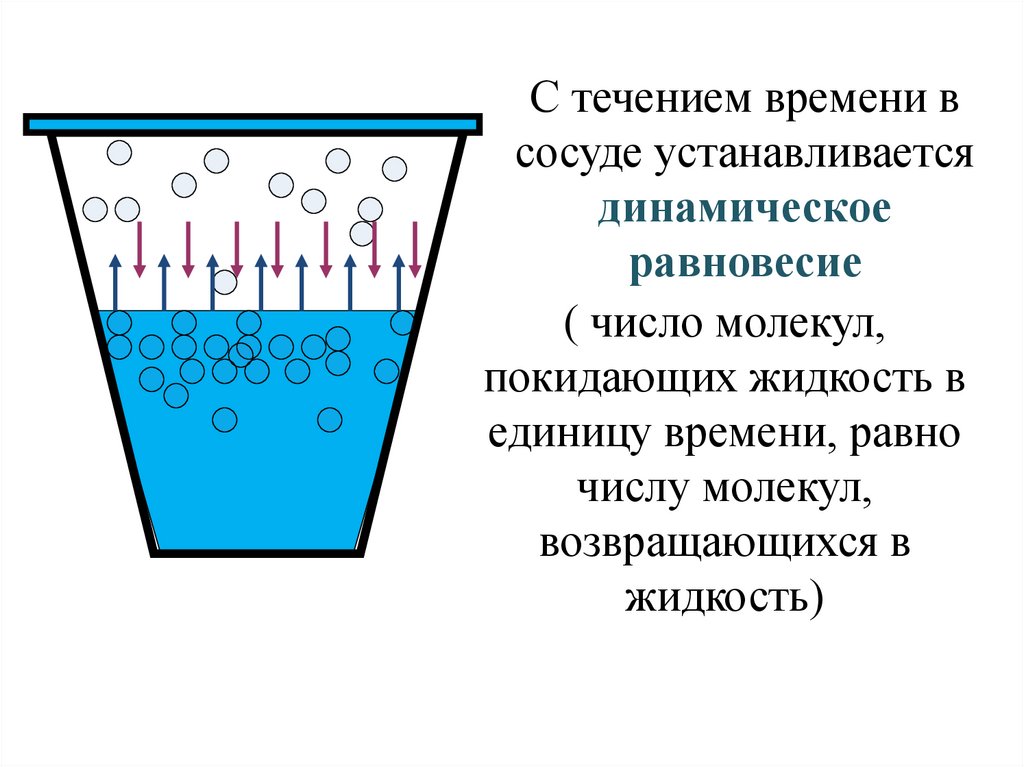
Если сосуд, в котором находится жидкость или газ, закупорен, то в таком случае его содержимое может находиться в динамическом равновесии, т.е. скорость процессов конденсации и испарения будет одинаковой (из жидкости будет испаряться столько молекул, сколько возвращается обратно из пара). Такая система получила название двухфазной.
Определение 4
Насыщенный пар – это пар, который находится со своей жидкостью в состоянии динамического равновесия.
Существует зависимость между количеством молекул, испаряющихся с поверхности жидкости в течение одной секунды, и температурой этой жидкости. Скорость процесса конденсации зависит от концентрации молекул пара и скорости их теплового движения, которая, в свою очередь, также находится в прямой зависимости от температуры. Следовательно, можно сделать вывод, что при равновесии жидкости и ее пара концентрация молекул будет определяться равновесной температурой. При повышении температуры необходима высокая концентрация молекул пара, чтобы испарение и конденсация стали одинаковыми по скорости.
Поскольку, как мы уже выяснили, концентрация и температура будут определять давление пара (газа), мы можем сформулировать следующее утверждение:
Определение 5
Давление насыщенного пара p определенного вещества не зависит от объема, но находится в прямой зависимости от температуры.
Именно по этой причине изотермы реальных газов на плоскости включают в себя горизонтальные фрагменты, которые соответствуют двухфазной системе.
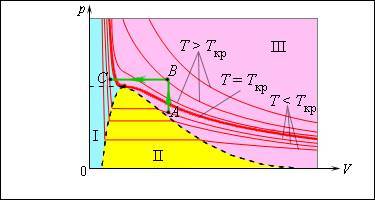
Рисунок 3.4.2. Изотермы реального газа. Область I – жидкость, область II – двухфазная система «жидкость + насыщенный пар», область III – газообразное вещество. K – критическая точка.
Если температура будет расти, увеличатся и давление насыщенного пара, и его плотность, а вот плотность жидкости, наоборот, будет снижаться из-за теплового расширения. При достижении критической для данного вещества температуры плотность жидкости и газа уравниваются, после прохождения этой точки физические различия между насыщенным паром и жидкостью исчезают.
Возьмем насыщенный пар и будем сжимать его изотермически при T<Tкр. Его давление будет постепенно возрастать, пока не сравняется с давлением насыщенного пара. Постепенно на дне сосуда появится жидкость, и между ней и ее насыщенным паром возникнет динамическое равновесие. По мере уменьшения объема будет происходить конденсация все большей части пара при неизменном давлении (на изотерме это состояние соответствует горизонтальному участку). После того, как весь пар перейдет в жидкое состояние, давление начнет резко увеличиваться при дальнейшем уменьшении объема, поскольку жидкость сжимается слабо.
Необязательно проходить двухфазную область, чтобы совершить переход от газа к жидкости. Процесс можно провести и в обход критической точки. На изображении такой вариант показан при помощи ломаной линии ABC.
Рисунок 3.4.3. Модель изотермы реального газа.
Воздух, которым мы дышим, при некотором давлении всегда включает в себя водяные пары. Это давление, как правило, меньше, чем давление насыщенного пара.
Определение 6
Относительная влажность воздуха – это отношение парциального давления к давлению насыщенного водяного пара.
В виде формулы это можно записать так:
φ=pp·100%.
Для описания ненасыщенного пара допустимо использовать и уравнение состояния идеального газа с учетом обычных для реального газа ограничений: не слишком большого давления пара (p≤(106–107) Па) и температуры выше значения, определенного для каждого конкретного вещества.
Для описания насыщенного пара применимы законы идеального газа. Однако при этом давление для каждой температуры должно быть определено по кривой равновесия для данного вещества.
Чем выше температура, тем выше давление насыщенного пара. Эту зависимость из законов идеального газа вывести нельзя. При условии постоянной концентрации молекул давление газа будет постоянно возрастать прямо пропорционально температуре. Если пар является насыщенным, то с ростом температуры будет расти не только концентрация, но и средняя кинетическая энергия молекул. Из этого следует, что чем выше температура, тем быстрее растет давление насыщенного пара. Этот процесс происходит быстрее, чем рост давления идеального газа при условии постоянной концентрации молекул в нем.
Таблетированные препараты от потливости
Для борьбы с гипергидрозом используются медикаментозные препараты. В отличие от инъекций ботокса и хирургического вмешательства, они действуют только в дни приема. При прекращении применения таких препаратов гипергидроз возвращается
Это удобно тем, что таблетки можно использовать только в нужные дни, например, перед важной встречей
Таблетки от потливости относятся к антихолинергическим средствам. Они блокируют ацетилхолин, затормаживая передачу нервных импульсов к потовым железам. Снижается потоотделение всего тела.
Три наиболее известных антихолинергических препарата:
- Гликопирролат;
- Бензтропин;
- Пропантелин.
Гликопирролат
Препарат для снижения потливости используется в США и Европе. Уменьшает секрецию пота и слюны.
Таблетки нужно принять за 3 часа до завтрака. Максимально допустимая суточная доза — 8 мг.
Помимо потоотделения, препарат снижает выработку слюны. На начальном этапе приема возможно возникновение сухости во рту. Рекомендовано использовать леденцы, пока организм привыкает к препарату.
Гликопирролат показывает высокую эффективность в снижении потоотделения. Около 90% пациентов получают нужный эффект. На оставшихся 10% людей, препарат не оказывает воздействия, в связи с индивидуальными особенностями организма.
Дозировка для людей в соответствии с весом:
- 50-65 кг — 1 мг;
- 70-85 кг — 2 мг;
- 85-120 кг — 4 мг.
Препарат принимают 1-2 раза в день. В большинстве случаев достаточно 1 приема.
Бензтропин
Блокирует выделение пота за счет регулирования ацетилхолина — нейромедиатора, отвечающего за потоотделение.
Оптимальная суточная доза — 2 мг в сутки, в редких случаях — 4 мг. Для избежания привыкания таблетки бензтропин пьют циклами по 5, 14, 30 дней с перерывами по 2, 5 и 10 дней.
Бензтропин совместим с большинством лекарств. Нельзя использовать в период беременности и кормления грудью.
Пропантелин
Препарат был разработан для лечения язвенной болезни. В дальнейшем было обнаружено, что таблетки предотвращают гипергидроз всего тела. Исследования показали эффективность пропантелина в борьбе с гипергидрозом. Из 200 пациентов, препарат оказал положительное действие на 160 человек.
15 мг нужно принять до завтрака, затем еще 15 мг через 2 часа после завтрака. Вместе с потоотделением замедляет секрецию желудочного сока. К побочным эффектам можно отнести появление сухости во рту, которая снижается через 1-2 недели после начала приема таблеток. Рекомендуется пить больше жидкости.
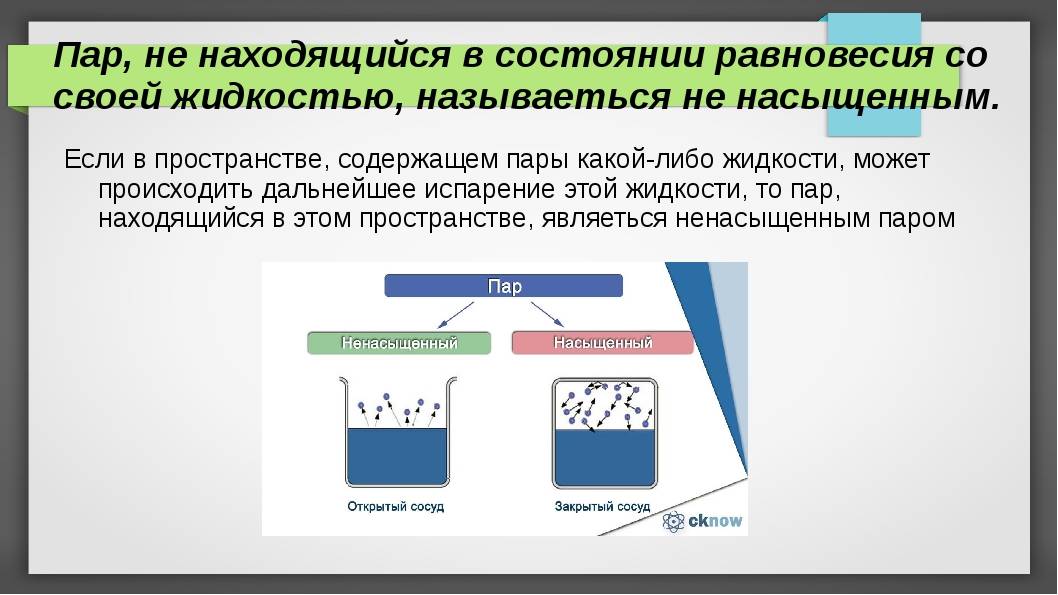
Что такое ненасыщенный пар
Если число частиц, покидающих вещество за единицу времени больше числа частиц возвращающихся обратно за то же время, то пар называется ненасыщенным. Значит, когда пар ненасыщен, процесс испарения идет не останавливаясь, и масса вещества в жидкой (или твердой) фазе уменьшается, а количество ненасыщенного пара увеличивается. Ситуация становится неравновесной: динамическое равновесие отсутствует.
Не следует путать водяной пар и туман, хотя и тот, и другой состоят из молекул воды. Туман образуется в атмосфере в результате конденсации водяных паров, которые собираются в мелкие водяные капли. При этом воздух утрачивает свою оптическую прозрачность. Водяной пар образовывается над поверхностями водоемов, оставаясь абсолютно прозрачным.
 Рис. 3. Пар, облака и туман.
Рис. 3. Пар, облака и туман.
Что мы узнали?
Итак, мы узнали, чем отличается насыщенный пар от ненасыщенного. Если число частиц, покидающих вещество за единицу времени больше числа частиц возвращающихся обратно за то же время, то пар называется ненасыщенным. Когда число молекул, покидающих вещество за единицу времени равно числу молекул возвращающихся обратно за то же время, то этом случае пар называется насыщенным.
/5
Вопрос 1 из 5
Испарение на молекулярном уровне
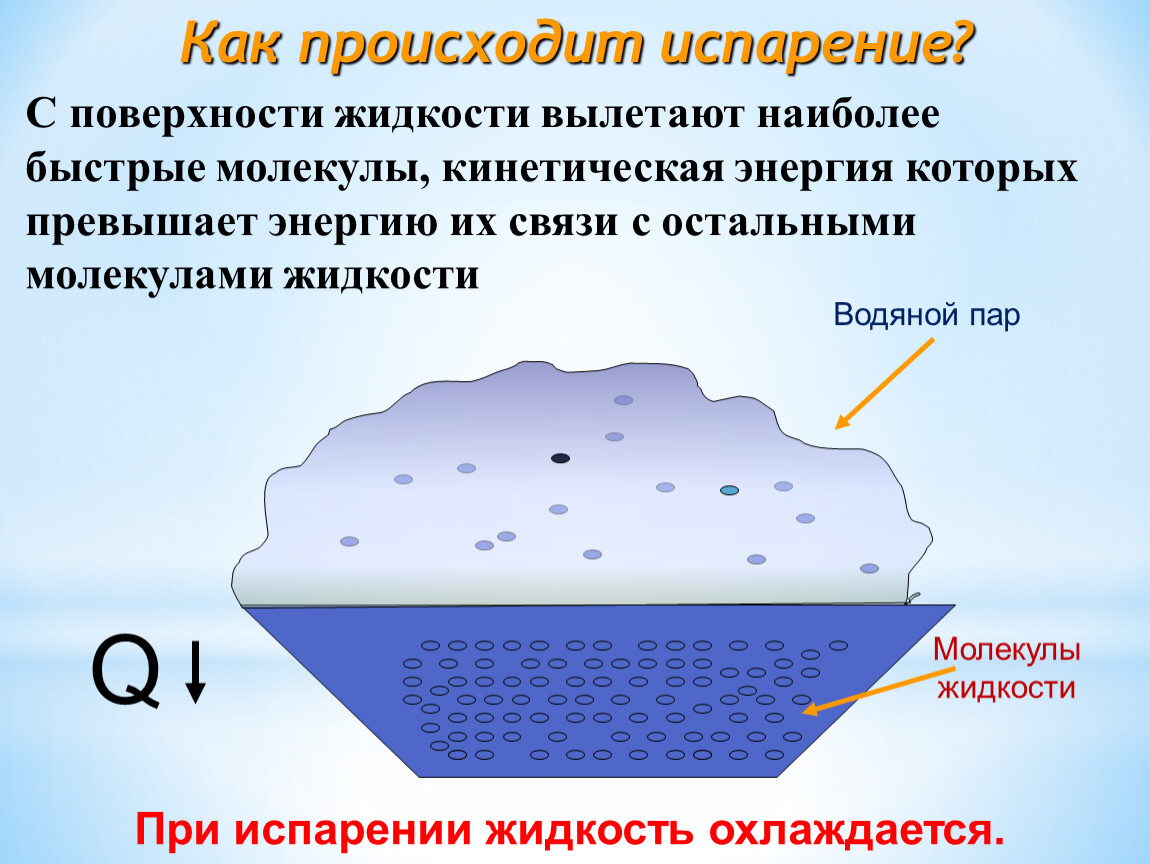
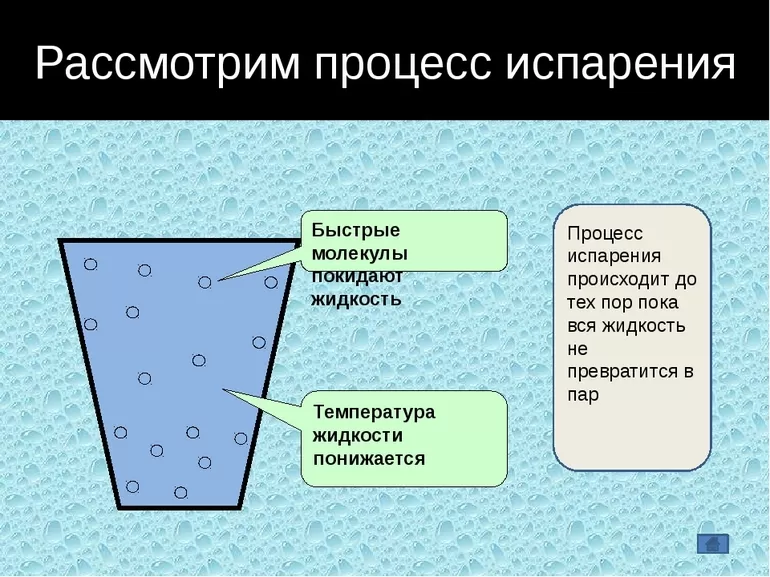
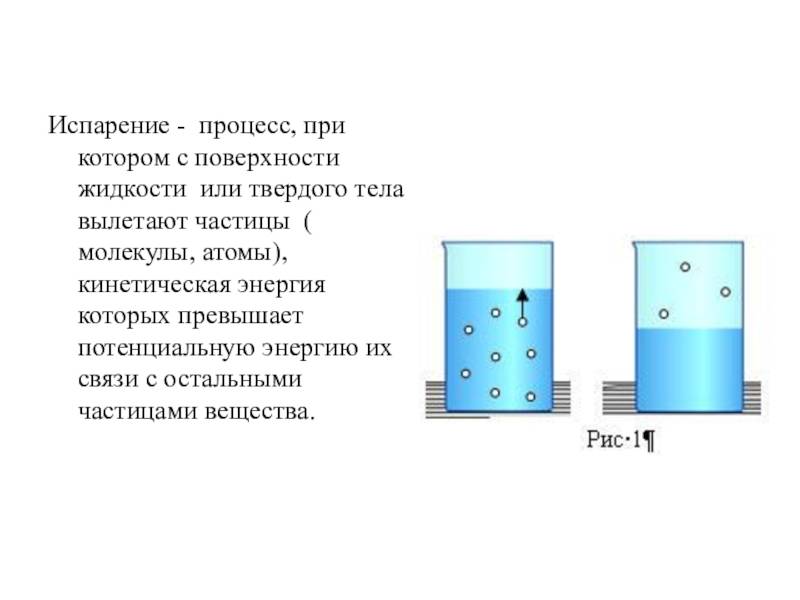
В жидких веществах молекулы расположены почти вплотную друг к другу, но не связаны, как в твёрдых субстанциях. Из-за этого они находятся в непрерывном движении, случайным образом сталкиваются друг с другом, меняют направление и скорость движения. Частицы, оказавшиеся близко к поверхности, со временем могут покинуть её, проникнув через зону фазового перехода.
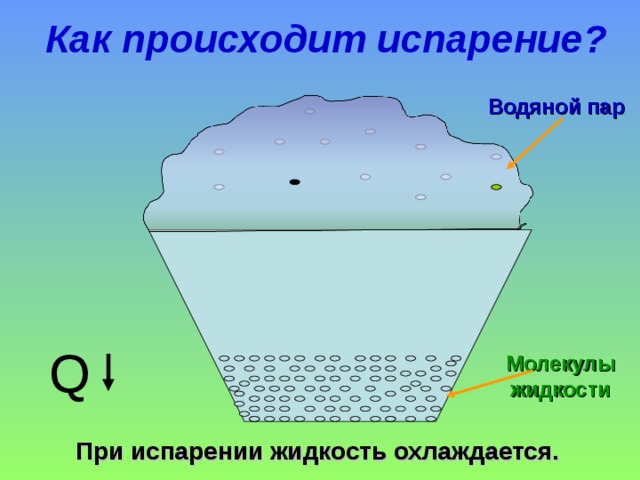
Таким образом, испарение обусловлено непрерывным движением молекул. Если они обладают достаточной кинетической энергией и скоростью, то часть из них может сорваться с поверхности воды, преодолевая притяжение соседних частиц. Некоторые отражаются и возвращаются, другие вырываются в газовую среду и навсегда покидают вещество. Процесс повторяется с новыми (теперь тоже поверхностными) частицами, пока вся жидкость не станет газообразной.

В процессе жидкость теряет часть своей энергии, из-за чего снижается также её температура — это обусловлено тем, что первыми её покидают самые быстрые (а значит, и обладающие наибольшей кинетической силой) молекулы. В результате наблюдается явление, называемое испарительным охлаждением жидкости. Этим объясняется то, что человеку быстро становится холодно в мокрой одежде, даже если ту облить тёплой водой. При комнатной температуре явление проявляется слабо, поскольку жидкость компенсирует теряемое тепло теплообменом с окружающим воздухом.
Процесс сублимации
Считается, что испарение – это переход из жидкого в газообразное агрегатное состояние. Однако в редких случаях, минуя жидкое, возможно испарение прямо из твердого состояния в газообразное. Такой процесс называется сублимацией.

Это слово знакомо всем, кто хоть раз заказывал кружку или футболку с любимой фотографией в фотосалоне. Для перманентного нанесения изображения на ткань или керамику как раз и используется этот вид испарения, в честь него печать такого рода называется сублимационной.
Также такое испарение часто используется для промышленной сушки фруктов и овощей, изготовления кофе.
Хотя сублимация встречается намного реже, нежели испарение жидкости, иногда ее можно наблюдать в быту. Так, вывешенное сушиться зимой постиранное влажное белье – мгновенно замерзает и становится твердым. Однако постепенно эта жесткость уходит, и вещи становятся сухими. В данном случае вода из состояния льда, минуя жидкую фазу, переходит сразу в пар.
Условия испарения
Наблюдая за лужами после дождя, можно заметить, что некоторые из них высыхают быстрее, а некоторые дольше. Поскольку их высыхание является процессом испарения, то можно на данном примере разобраться с условиями, необходимыми для этого.
- Скорость испарения зависит от типа испаряемого вещества, ведь каждое из них имеет уникальные особенности, влияющие на время, за которое его молекулы полностью перейдут в газообразное состояние. Если оставить открытыми 2 идентичных флакона, наполненных одинаковым количеством жидкости (в одном спирт С2Н5ОН, в другом – вода Н2О), то первая емкость опустеет быстрее. Поскольку, как уже было сказано выше, температура испарения у спирта ниже, а значит, он быстрее испарится.
- Второе, от чего зависит испарение, – температура окружающей среды и температура кипения испаряемого вещества. Чем выше первая и ниже вторая, тем быстрее жидкость сможет ее достигнуть и перейти в газообразное состояние. Именно поэтому при проведении некоторых химических реакций с участием испарения вещества специально нагреваются.
- Еще одним условием, от чего зависит испарение, является площадь поверхности вещества, с которого оно происходит. Чем она больше, тем быстрее происходит процесс. Рассматривая различные примеры испарения, можно снова вспомнить о чае. Его часто переливают в блюдце, чтобы охладить. Там напиток быстрее остывал, потому что увеличивалась площадь поверхности жидкости (диаметр блюдца больше диаметра чашки).
- И снова о чае. Известен еще одни способ быстрее его остудить – подуть на него. Каким образом можно заметить, что наличие ветра (движения воздуха) – это то, от чего также зависит испарение. Чем выше скорость ветра, тем быстрее молекулы жидкости перейдут в пар.
- Также влияет на интенсивность испарения атмосферное давление: чем оно ниже, тем быстрее молекулы переходят из одного состояния в другое.
Как используют испарение в промышленности и в быту
Для химической и пищевой промышленности испарение – это незаменимый процесс. Как уже было сказано выше, оно не только помогает производить дегидратацию многих продуктов (испарять влагу из них), что увеличивает срок их хранения; но также помогает изготавливать идеальные диетические продукты (меньше веса и калорий, при большем содержании полезных веществ).
Также испарение (в особенности сублимация) используется для очистки различных веществ.
Еще одной сферой применения является кондиционирование воздуха.

Не стоит забывать и о медицине. Ведь процесс ингаляции (вдыхание пара, насыщенного лечебными препаратами) основан тоже на процессе испарения.
Сублимация и десублимация
Мы уже рассказали про такие процессы, как сублимация и десублимация.
- Переход из твердого состояния в газообразное, минуя жидкое — сублимация (возгонка);
- Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
Примерчики из жизни Про белье. Попробуйте повесить белье сушиться на улицу в мороз. Поскольку вода замерзает из-за низких температур, белье должно вернуться домой в виде большого айсберга, но этого не происходит — оно возвращается абсолютно сухим. В данном процессе произошла возгонка молекул воды (сублимация). Про принтеры. Цветные принтеры (только не лазерные) печатают путем сублимации. Вот как это работает: частицы краски быстро переходят из твердого состояния в газообразное и оседают на бумаге — так получается цветная картинка. Рисуночки на окнах. Если вы решите проехаться на автобусе в холодную погоду — увидете на стеклах чудесные узоры. Из-за огромной разницы температур между улицей и автобусом, мы можем наблюдать процесс десублимации в виде красивых рисунков на стеклах. Иней образуется похожим способом — резкое похолодание приводит к десублимации воздуха. |
ПРИМЕРЫ ЗАДАНИЙ
Часть 1
1. Испарение и кипение — два процесса превращения вещества из одного агрегатного состояния в другое. Общей характеристикой этих процессов является то, что оба они
А. Представляют собой процесс превращения вещества из жидкого состояния в газообразное
Б. Происходят при определённой температуре
Правильный ответ
1) только А
2) только Б
3) и А, и Б
4) ни А, ни Б
2. Испарение и кипение — два процесса перехода вещества из одного агрегатного состояния в другое. Различие между ними заключается в том, что
А. Кипение происходит при определённой температуре, а испарение — при любой температуре.
Б. Испарение происходит с поверхности жидкости, а кипение — во всём объёме жидкости.
Правильным(-и) является(-ются) утверждение(-я)
1) только А
2) только Б
3) и А, и Б
4) ни А, ни Б
3. При нагревании вода превращается в пар той же температуры. При этом
1) увеличивается среднее расстояние между молекулами
2) уменьшается средний модуль скорости движения молекул
3) увеличивается средний модуль скорости движения молекул
4) уменьшается среднее расстояние между молекулами
4. В процессе конденсации водяного пара при неизменной его температуре выделилось некоторое количество теплоты. Что произошло с энергией молекул водяного пара?
1) изменилась как потенциальная, так и кинетическая энергия молекул пара
2) изменилась только потенциальная энергия молекул пара
3) изменилась только кинетическая энергия молекул пара
4) внутренняя энергия молекул пара не изменилась
5. На рисунке приведён график зависимости температуры воды от времени при её охлаждении и последующем нагревании. Первоначально вода находилась в газообразном состоянии. Какой участок графика соответствует процессу конденсации воды?
1) АВ
2) ВС
3) CD
4) DE
6. На рисунке приведён график зависимости температуры воды от времени. В начальный момент времени вода находилась в газообразном состоянии. В каком состоянии находится вода в момент времени \( \tau_1 \)?
1) только в газообразном
2) только в жидком
3) часть воды в жидком состоянии, часть — в газообразном
4) часть воды в жидком состоянии, часть — в кристаллическом
7. На рисунке приведён график зависимости температуры спирта от времени при его нагревании и последующем охлаждении. Первоначально спирт находился в жидком состоянии. Какой участок графика соответствует процессу кипения спирта?
1) АВ
2) ВС
3) CD
4) DE
8. Какое количество теплоты необходимо затратить, чтобы превратить в газообразное состояние 0,1 кг спирта при температуре кипения?
1) 240 Дж
2) 90 кДж
3) 230 кДж
4) 4500 кДж
9. В понедельник абсолютная влажность воздуха днём при температуре 20 °С была равной 12,8 г/см3. Во вторник она увеличилась и стала равной 15,4 г/см3. Выпала ли роса при понижении температуры до 16 °С, если плотность насыщенного пара при этой температуре 13,6 г/см3?
1) не выпала ни в понедельник, ни во вторник
2) выпала и в понедельник, и во вторник
3) в понедельник выпала, во вторник не выпала
4) в понедельник не выпала, во вторник выпала
10. Чему равна относительная влажность воздуха, если при температуре 30 °С абсолютная влажность воздуха равна 18·10-3 кг/м3, а плотность насыщенного пара при этой температуре 30·10-3 кг/м3?
1) 60%
2) 30%
3) 18 %
4) 1,7 %
11. Для каждого физического понятия из первого столбца подберите соответствующий пример из второго столбца. Запишите в таблицу выбранные цифры под соответствующими буквами.
ФИЗИЧЕСКИЕ ПОНЯТИЯ
A) физическая величина
Б) единица физической величины
B) прибор для измерения физической величины
ПРИМЕРЫ
1) кристаллизация
2) джоуль
3) кипение
4) температура
5) мензурка
12. На рисунке приведены графики зависимости от времени температуры двух веществ одинаковой массы, находившихся первоначально в жидком состоянии, получающих одинаковое количество теплоты в единицу времени. Из приведённых ниже утверждений выберите правильные и запишите их номера.
1) Вещество 1 полностью переходит в газообразное состояние, когда начинается кипение вещества 2
2) Удельная теплоёмкость вещества 1 больше, чем вещества 2
3) Удельная теплота парообразования вещества 1 больше, чем вещества 2
4) Температура кипения вещества 1 выше, чем вещества 2
5) В течение промежутка времени \( 0-t_1 \) оба вещества находились в жидком состоянии
Часть 2
13. Какое количество теплоты необходимо для превращения в стоградусный пар 200 г воды, взятой при температуре 40 °С? Потерями энергии на нагревание окружающего воздуха пренебречь.
Испарение на уровне молекул
Давайте вспомним об особенностях разных агрегатных состояний вещества.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
занимают предоставленный объем
больше размеров молекул
хаотичное и непрерывное
Из этой таблицы видно, что молекулы в жидкостях находятся близко друг другу, но хаотично, то есть не имеют кристаллической решетки, как в твердых телах. Эти молекулы движутся (причем, чем выше температура, тем быстрее движутся) и в ходе движения сталкиваются. Столкновения меняют направление и скорость движения — из-за этого молекулы иногда быстро устремляются к поверхности жидкости и вылетают из нее. Это и есть испарение.
В предыдущем абзаце мы не случайно заметили, что молекулы движутся быстрее при увеличении температуры — ведь из-за этого испарение идет интенсивнее. В этом случае происходит охлаждение: нагретую жидкость уже покинули все самые быстрые молекулы и температура самой жидкости понижается.