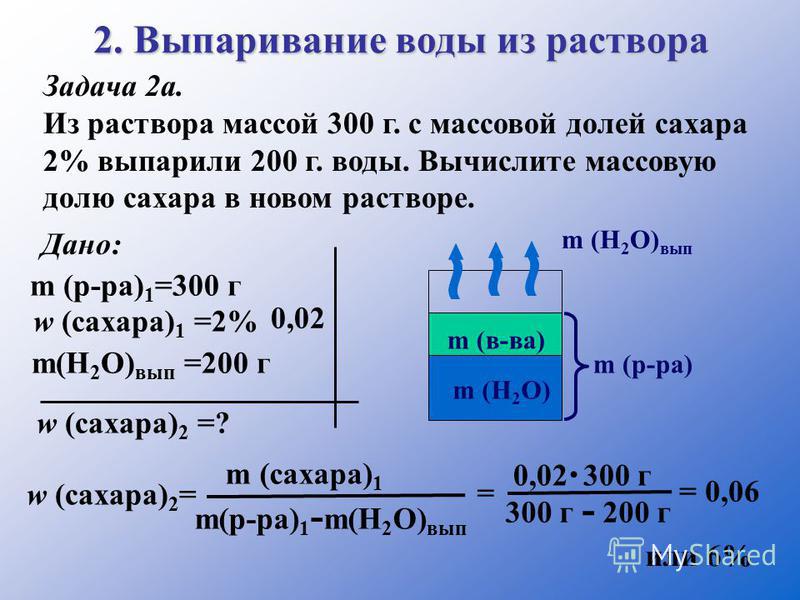
Структура хлорида натрия
Компактная кубическая структура хлорида натрия представлена на верхнем рисунке. Объемные зеленые сферы соответствуют анионам Cl-, в то время как белый, к катионам Na+
Обратите внимание, что кристалл NaCl состоит из сети ионов, упорядоченных по электростатическим взаимодействиям в соотношении 1: 1.
Хотя столбцы показаны на изображении, связи не ковалентные, а ионные. Использование столбцов полезно при отображении координационной геометрии вокруг иона. Например, в случае NaCl каждый Na+ окружен шестью Cl- (белый октаэдр), и каждый Cl- из шести Na+ (зеленый октаэдр).
Следовательно, он имеет координацию (6,6), номера которой указывают, сколько соседей окружает каждый ион. Число справа указывает на соседей Na+, в то время как слева-.
Другие представления опускают использование полос, чтобы выделить октаэдрические отверстия, которые имеет структура, которые являются результатом межузельного пространства между шестью анионами Cl.- (или катионы Na+упаковано. Такое расположение наблюдается в других моно (MX) или многоатомных неорганических солях и называется солью драгоценного камня..
Унитарная ячейка
Элементарная ячейка каменной соли является кубической, но какие именно кубы точно представляют ее на изображении выше? Октаэдры дают ответ. Оба покрывают в общей сложности четыре маленьких кубика.
У этих кубиков есть части ионов в их вершинах, краях и гранях
Соблюдая осторожность, ион Na+ он расположен в центре и двенадцать из них по краям. Ион на одном ребре может быть разделен на четыре куба
Таким образом, есть 4 иона Na+ (12 × 1/4 + 1 = 4).
Для ионов Cl-, восемь расположены в вершинах и шесть по краям. Поскольку ионы, расположенные в вершинах, делят пространство с восемью другими кубами, а на краях с шестью, они имеют 4 иона Cl- (8 × 1/8 + 6 × 1/2 = 4).
Предыдущий результат интерпретируется следующим образом: в элементарной ячейке NaCl имеется четыре катиона Na+ и четыре Cl-аниона-; пропорция, которая соответствует химической формуле (Na+ для каждого Cl-).
Инструкция по применению Натрия Хлорида (Способ и дозировка)
Инструкция на физ раствор (изотонический раствор) предусматривает его введение внутривенно и подкожно.
В большинстве случаев практикуется внутривенное капельное введение, для чего капельница Хлорида Натрия прогревается до температуры 36-38 градусов. Объем, который вводят пациенту, зависит от того, в каком состоянии пациент, а также от того количества жидкости, которая была потеряна организмом
При этом важно учесть возраст человека и его вес
Средняя суточная доза препарата — 500 мл, вводится раствор со средней скоростью 540 мл/ч. Если отмечается сильная степень интоксикации, то максимальный объем лекарства в сутки может составлять 3000 мл. Если существует такая необходимость, можно вводить объем 500 мл на скорости 70 капель в минуту.
Детям вводится доза от 20 до 100 мл в сутки на 1 кг веса. Дозировка зависит от массы тела, от возраста ребенка. Следует учитывать, что при продолжительном применении этого лекарства необходимо обязательно контролировать уровень электролитов в плазме и моче.
Чтобы развести препараты, которые нужно вводить капельно, применяется от 50 до 250 мл натрия хлорида на одну дозу лекарства. Определение особенностей введения проводится по основному лекарству.
Введение гипертонического раствора проводится внутривенно струйно.
Если раствор применяется с целью немедленного восполнения дефицита ионов натрия и хлора, вводится капельно 100 мл раствора.
Чтобы провести ректальную клизму для вызывания дефекации, вводят 100 мл 5% раствора, также можно ввести на протяжении суток 3000 мл изотонического раствора.
Применение гипертонической клизмы медленно показано при почечных и сердечных отеках, повышенном внутричерепном давлении и при гипертонии проводится медленно, вводится 10-30 мл. Нельзя проводить такую клизму при эрозии толстой кишки и воспалительных процессах.
Гнойные раны раствором проводят согласно с той схемой, которую назначает врач. Компрессы с NaCl прикладывают непосредственно к ране или другому поражению на коже. Такой компресс способствует отделению гноя, гибели патогенных микроорганизмов.
Назальный спрей закапывают в полость носа после ее очищения. Взрослым пациентам закапывают по две капли в каждую ноздрю, детям – по 1 капле. Применяется как для лечения, так и для профилактики, для чего капают раствор на протяжении примерно 20 дней.
Натрия хлорид для ингаляций применяется при простудных заболеваниях. Для этого раствор смешивают с бронхолитическими препаратами. Ингаляция проводится на протяжении десяти минут трижды в день.
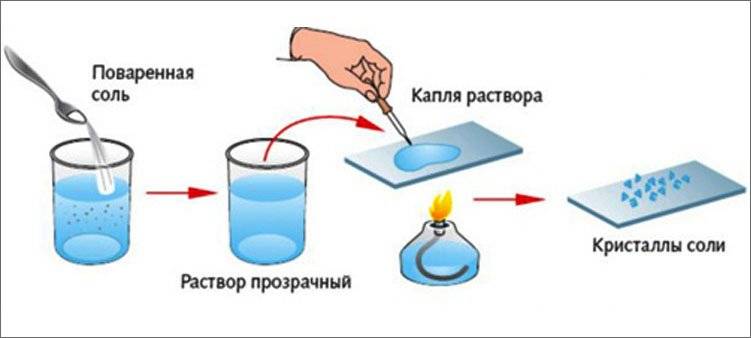
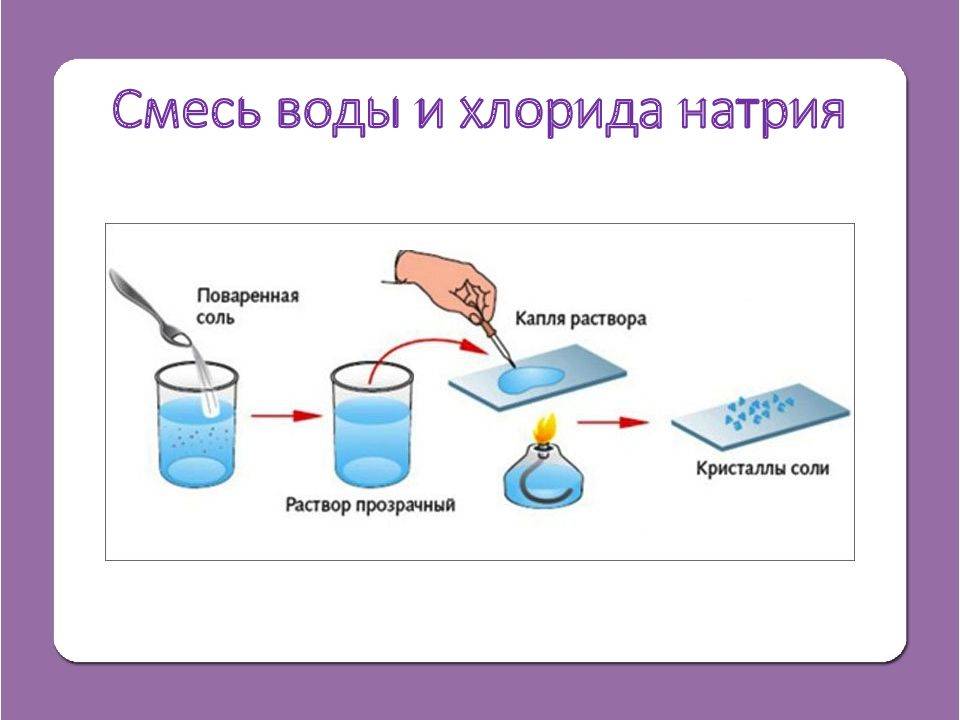
При крайней необходимости физраствор можно приготовить в домашних условиях. Для этого полную чайную ложку поваренной соли нужно размешать в одном литре кипяченной воды. При необходимости приготовить определенного количество раствора, например, с солью массой 50 г, следует провести соответствующие измерения. Такой раствор можно применять местно, использовать для клизм, полосканий, ингаляций. Однако ни в коем случае нельзя такой раствор вводить внутривенно или использовать для обработки открытых ран или глаз.
Минеральная водоподготовка
Повышенная минерализация воды способствует обрастанию трубопроводов и оборудования отложениями кальциевыми и магниевыми солями. Дорогая бытовая техника, контактирующая с высокоминерализованной водой, требует частой очистки, а без должного ухода выходит из строя. Ежедневное употребление воды, насыщенной солями, воздействует на человеческий организм не лучшим образом.
Очистка
В ходе водоподготовки минерализацию воды снижают:
- дистилляцией;
- электромембранной очисткой (электродиализом);
- баромембранным методом (обратным осмосом).
Дистилляция
Суть метода заключается в испарении жидкости при нагревании и последующем ее конденсировании. Чистая вода закипает при 100 ⁰С, затем испаряется, а примеси с другой температурой кипения остаются на стенках испарителя.
Метод непопулярен из-за высокой энергоемкости процесса дистилляции и неизменного нарастания «шубы» из накипи на нагревательных элементах дистиллятора.
Электродиализ
Ионы металлов и кислотных остатков способны двигаться под действием электрического тока в направлении противоположно заряженных электродов. На этой способности основано обессоливание воды методом электродиализа в специальной емкости, разделенной двумя мембранами на три секции. В крайних секциях расположены электроды, которые притягивают к себе заряженные ионы. Катионы и анионы из межмембранного пространства проходят через мембраны к электродам и собираются там, а в межмембранном пространстве остается вода с пониженным уровнем минерализации.
Обратный осмос
Эффективный и экономически выгодный метод удаления солей из воды – обратный осмос. В основе обратноосмотического фильтра – полупроницаемая мембрана, задерживающая практически все примеси, но беспрепятственно пропускающая воду. Минерализованная вода подается на мембрану под давлением, которое создается специальным повысительным насосом. Вода на выходе из фильтра очищается от солей практически на 100 %, при этом неизбежно становится безвкусной.
Поэтому следующим этапом подготовки высокоочищенной воды становится насыщение ее необходимыми минералами.
Процесс обогащения воды минералами происходит в минерализаторе – картридже с насыщенным раствором солей. Минерализатор восстанавливает водно-солевой состав очищенной воды, улучшая ее вкус. Небольшие дозы ионов кальция, магния, натрия подаются в очищенную воду, приближая ее по уровню растворенных солей к природной.
Природные и сточные воды
Минеральное наполнение природных вод очень разное. Есть пресные воды с минерализацией менее 1 г/дм3 и рассолы с концентрацией солей более 50 г/дм3.
Атмосферные осадки слабоминерализованны, общая минерализация дождя и снега колеблется в пределах от 10 до 30 мг/дм3. Зимой солей в осадках больше, чем в летние месяцы. Снежинка благодаря своей структуре способна захватить из воздуха большее количество примесей. В тундре и над тайгой осадки чище, так как атмосфера не загрязнена, а над пыльными пустынями и степями минерализация осадков резко возрастает. На побережьях дождь содержит больше хлоридов, чем в глубине континента, где преобладают сульфаты в виде диоксида серы.
В природных водах превалируют катионы Mg2+, Na+, K+, Ca2+ и анионы HCO3-, SO42-, Cl—. По главному аниону воды подразделяют на три класса – гидрокарбонатный, хлоридный, сульфатный.
По преобладающему катиону определяется группа вод:
- магниевая;
- натриевая;
- кальциевая.
Природные воды различного происхождения обычно имеют различный солевой состав и относятся соответственно к разным классам и группам.
| Наименование вод | Класс | Группа |
| подземные | сульфатный | магниевая |
| речные | гидрокарбонатный | кальциевая |
| морские, океанические | хлоридный | натриевая |
Свой негативный вклад в изменение минерализации природных вод вносят промышленные сточные воды, а также городские «ливневки». Резко возрастает приток солей в реки ранней весной, когда тает снег, смешанный с противогололедным реагентом. В стоках с улиц городов показатель минерализации колеблется от 400 до 800 мг/дм3.
Общая минерализация многих производственных сточных вод достигает 1000-3000 мг/дм3. Высокоминерализованные сточные воды промышленных производств (ВМСВ) признаются экологами одним из самых распространенных и опасных загрязняющих факторов. В производственных стоках ТЭЦ, горнодобывающей промышленности, гальванических производств присутствуют высокие концентрации солей натрия, магния и кальция. Для очистки заводских сточных вод, насыщенных солями в самых причудливых сочетаниях, рационально использовать комплексную технологию глубокого обессоливания на базе двухступенчатого обратного осмоса.
Различия в технологиях производства технической, пищевой и кормовой соли
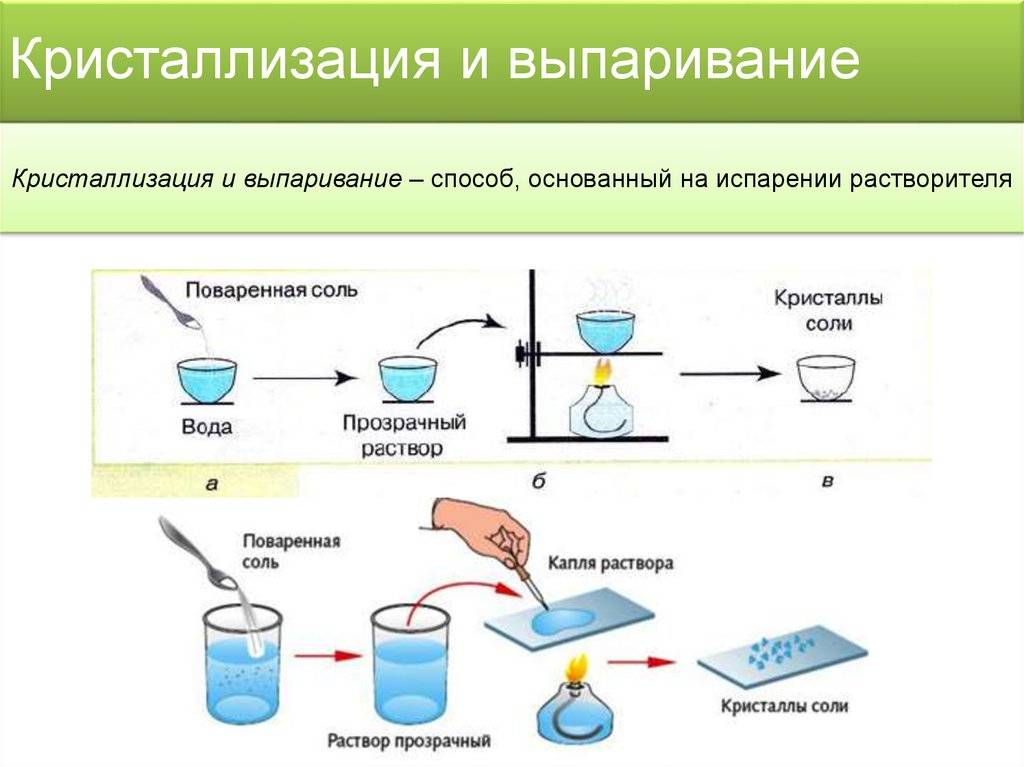
Получение технической соли
Такую соль доставляют с месторождения, очищают от твердых галитовых отходов на металлоулавливателе, дробят до получения нужного размера. При необходимости продукцию обрабатывают антислеживателем.
Производство пищевой соли
Состоит из следующих этапов:
- Очистка. Галит проходит несколько моек, затем его дробят и специальным сепаратором извлекают ненужные металлические примеси.
- Сушка производится при помощи промышленной центрифуги.
- Дробление. Соль отправляют на вибрационный транспортер, где гранулы приобретают нужный размер.
- Окончательное высушивание производится в печи, где горячий воздух нагнетается промышленным вентилятором.
Процесс производства кормовой соли
Соль-лизунец изготавливают из чистой самосадочной соли на специальных станках. Кристаллический хлористый натрий засыпают в лотки, где под давлением они превращаются в брикет, по плотности похожий на камень. Еще один вариант для изготовления брикетов – использовать вибростол.
Производство таблетированной соли
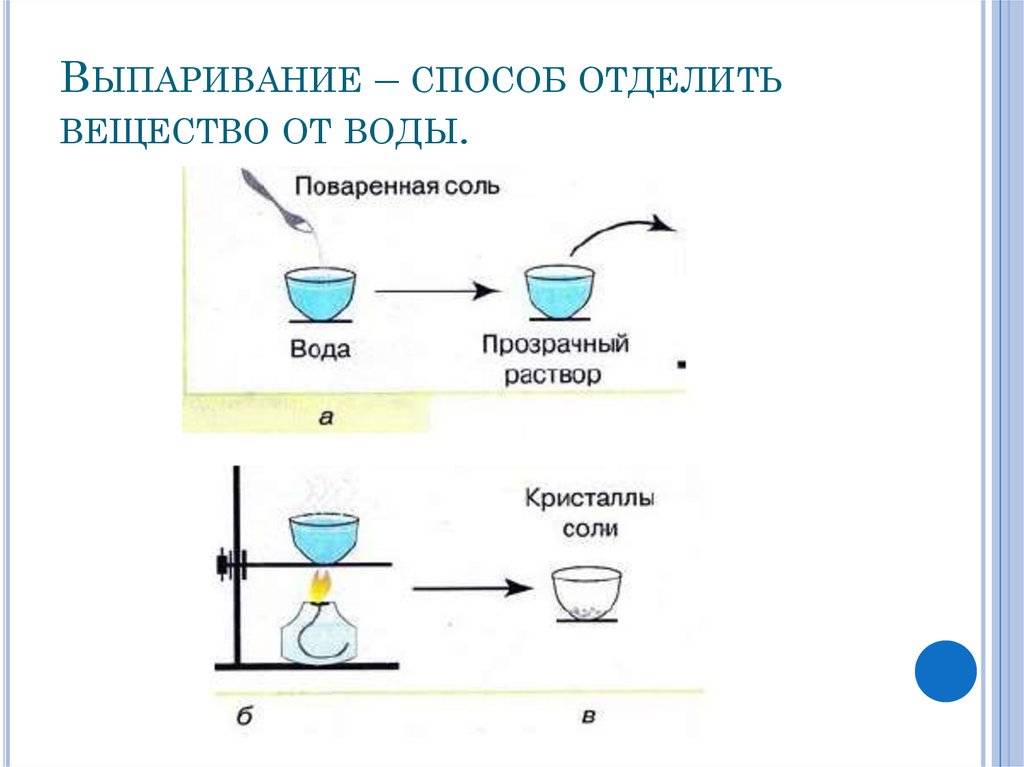
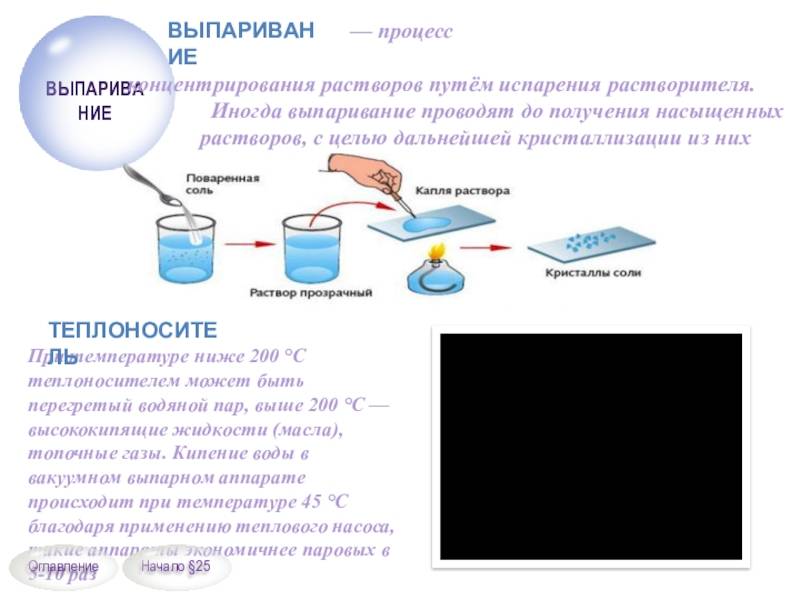
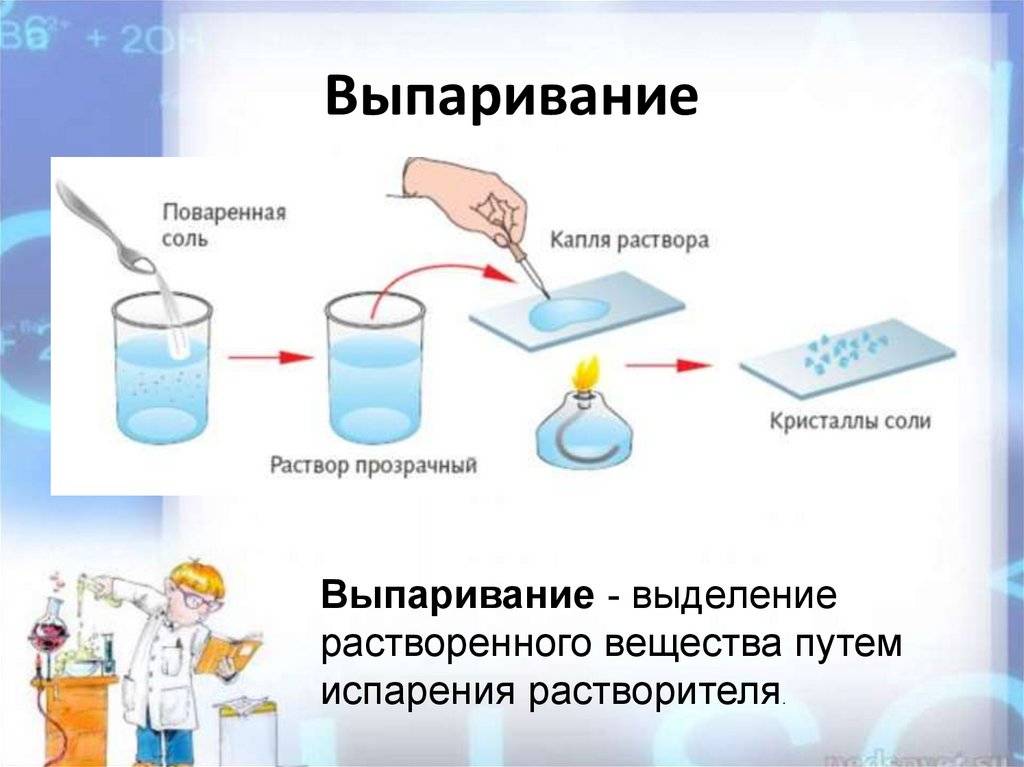
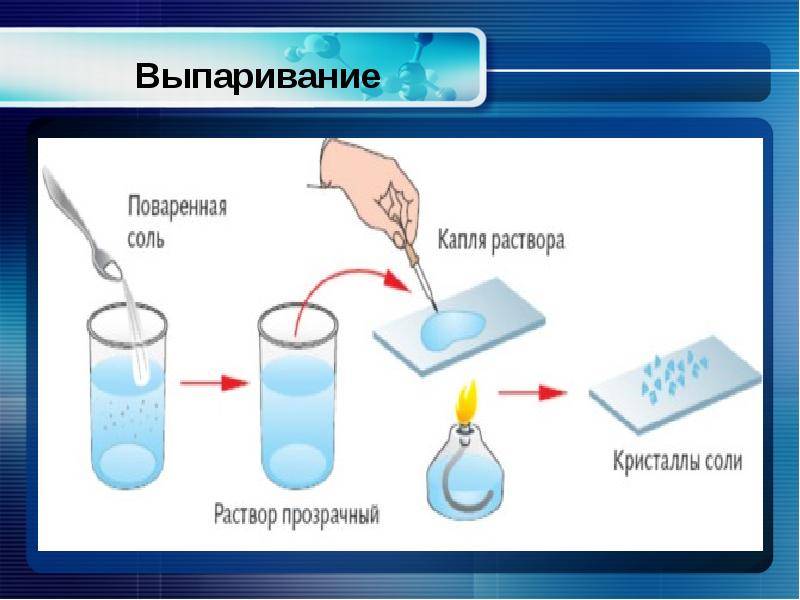
Для изготовления таблеток используется сырье высокой степени очистки. Содержание натрий хлора достигает 99,7%. Продукт получают путем выпаривания на специальном оборудовании, дозирования и прессования в таблетки.
Катионы и анионы
Другие соли образуются по аналогичному принципу, что и хлорид натрия. Металл отдает электроны, а неметалл их получает. Из периодической таблицы видно, что:
- элементы группы IA (щелочные металлы) отдают один электрон и образуют катион с зарядом 1+;
- элементы группы IIA (щелочноземельные металлы) отдают два электрона и образуют катион с зарядом 2+;
- элементы группы IIIA отдают три электрона и образуют катион с зарядом 3+;
- элементы группы VIIA (галогены) принимают один электрон и образуют анион с зарядом 1-;
- элементы группы VIA принимают два электрона и образуют анион с зарядом 2-;
- элементы группы VA принимают три электрона и образуют анион с зарядом 3-;
Распространенные одноатомные катионы
| Группа | Элемент | Ион | Обозначение |
| IA | Литий Натрий Калий | Катион лития Катион натрия Катион калия | Li+ Na+ K+ |
| IIA | Бериллий Магний Кальций Стронций Барий | Катион бериллия Катион магния Катион кальция Катион стронция Катион бария | Be2+ Mg2+ Ca2+ Sr2+ Ba2+ |
| IB | Серебро | Катион серебра | Ag+ |
| IIB | Цинк | Катион цинка | Zn2+ |
| IIIB | Алюминий | Катион алюминия | Al3+ |
Распространенные одноатомные анионы
| Группа | Элемент | Ион | Обозначение |
| VIIA | Фтор Хлор Бром Йод | Анион фтора Анион хлора Анион брома Анион йода | F- Cl- Br- I- |
| VIA | Кислород Сера | Анион кислорода Анион серы | O2- S2- |
| VA | Азот Фосфор | Аниона азота Анион фосфора | N3- P3- |
Не все так просто с переходными металлами (группа В), которые могут отдавать разное количество электронов, образуя при этом по два (и более) катиона, имеющих разные заряды. Например:
- Cr2+ – ион двухвалентного хрома; хром (II)
- Mn3+ – ион трехвалентного марганца; марганец (III)
- Hg22+ – ион двухатомной двухвалентной ртути; ртуть (I)
- Pb4+ – ион четырехвалентного свинца; свинец (IV)
| Электрический заряд, который получает атом, называется степенью окисления |
Многие ионы переходных металлов могут иметь разную степень окисления.
Ионы не всегда бывают одноатомными, они могут состоять из группы атомов – многоатомные ионы. Например, ион двухатомной двухвалентной ртути Hg22+: два атома ртути связаны в один ион и имеют общий заряд 2+ (каждый катион имеет заряд 1+).
Примеры многоатомных ионов:
- SO42- – сульфат
- SO32- – сульфит
- NO3– – нитрат
- NO2– – нитрит
- NH4+ – аммоний
- PO43+ – фосфат
Значение морской соли для организма
Соль, добываемая из морских глубин, обладает уникальными качествами. В лабораторных условиях ученые до сих пор не смогли вывести ее аналог, несмотря на то, что состав кристалла давно известен. Эзотерики утверждают, что соль, получаемая из морской воды, обладает большой силой природной энергии, которая наполняет организм человека гармонией и здоровьем .
Испокон веков хлористый натрий использовали как природный консервант, увеличивающий срок годности продуктов. На его основе готовили составы для продления молодости и красоты.
Влияние соли на организм человека:
- регулирует и поддерживает в пределах нормы водный баланс, натрий-калиевый ионный обмен;
- избавляет от спазмов гладкой мускулатуры;
- снабжает организм макро- и микроэлементами, в частности натрием;
- успокаивает нервную систему;
- способствует синтезу соляной кислоты;
- тормозит гнилостные процессы в ЖКТ (за счет антисептических свойств);
- ускоряет метаболизм;
- способствует формированию клеточных оболочек, образованию эритроцитов;
- поддерживает нормальный гормональный, липидный обмен, функцию половых желез;
- улучшает состояние кожных покров.
Соль выступает противоаллергическим, дезинфекционным агентом. Ее полезно не только употреблять внутрь, но и использовать наружно в качестве ванн, ингаляций, в составе масок. Так, соляные компрессы под глаза избавляют от мешков, полоскания с добавлением соды снимают воспаления миндалин, а ванночки избавляют от отека ног .
Факты
- В США продаются различные продукты, рекламируемые как «соль с пониженным содержанием натрия» (англ. low sodium salt). Уменьшение содержания натрия достигается за счёт снижения количества поваренной соли на единицу объёма. Один из вариантов производства — частичное замещение хлорида натрия другими химическими соединениями, такими, как хлорид калия или магния. Другой вариант — изменение исходной кристаллической структуры соли («снежинки» вместо характерных призм), в результате чего её объёмная плотность уменьшается (0,76 г/см³ против 1,24 г/см³ у «обычной» соли), и одна ложка продукта содержит на треть меньше натрия (да и соли как таковой).
- Известно, что, уходя из таёжного приюта, охотники непременно оставляют спички и соль для случайных путников.
На Руси издавна было принято в Страстной четверг готовить так называемую «четверговую соль» — крупную соль смешивали с квасной гущей или мякишем ржаного хлеба и перекаливали на сковороде, после чего толкли в ступе. Четверговую соль употребляли с пасхальными яйцами и некоторыми другими блюдами.
Гадание посредством соли именуется аломантия.
3.3. Результаты исследования потребления поваренной соли моей семьей
В моей семье 5 человек. Я решил узнать, сколько соли съедает в день наша семья.
Одну пачку соли (1 пачка соли = 1кг = 1000г) мы в зимнее время используем в течение 65 дней. Значит, в день на каждого члена семьи приходится:
1000 г : 5 (членов семьи) : 65 дня = 3,1г (соли из пачки)
Вывод: каждый член нашей семьи в сутки получает приблизительно
3,1 грамма соли в виде добавки к пище, что соответствует норме (норма: не более 3-5г). Однако нам все-таки стоит задуматься над количеством потребляемой соли. Тем более что при гипертонии и болезни почек (а именно эти болезни есть у членов моей семьи!) количество соли следует снизить!
Методы определение минерализации воды
ГОСТ Р 51232-98 отождествляет понятия «сухой остаток» и «общая минерализация». Для определения «сухого остатка» требуется выпарить 1 дм3 воды и взвесить то, что осталось после этой процедуры, то есть все твердые вещества.
Параметр «сухой остаток» в лабораториях определяют двумя методами – гравиметрическим и кондуктометрическим. Гравиметрический метод предполагает предварительное выпаривание пробы воды, а затем высушивание и взвешивание осадка. Этот метод требует временных затрат, поэтому в лабораториях общую минерализацию чаще всего определяют помощью кондуктометра, измеряя прибором электропроводность воды. Портативный кондуктометр позволяет сделать быстрый вывод о минерализации воды в лабораторных и в походных условиях. Электропроводность воды напрямую зависит от концентрации растворенных солей, ионы которых переносят электрический заряд. Чем больше концентрация в жидкости положительно и отрицательно заряженных частиц, тем выше электропроводность.
Обзор методик по ГОСТу
Для определения сухого остатка по ГОСТ 18164-72 используют две варианта анализа:
- без соды;
- с добавлением соды.
Первый вариант предполагает выпаривание порции исследуемой воды на водяной бане, а затем высушивание фарфоровой чашки с осадком до постоянной массы (при t=110 ⁰С в термостате).
Второй вариант определения сухого остатка предполагает добавление к пробе во время выпаривания карбоната натрия (соды).
Гигроскопичные хлориды кальция и магния при повышении температуры подвергаются гидролизу, а кристаллогидраты CaSO4, MgSO4 тяжело отдают воду, поэтому результаты исследования завышаются. Чтобы получить достоверные данные, к пробе добавляют точно отмеренный объем 1%-го раствора карбоната натрия, по массе в два раза превышающий предполагаемый сухой остаток в пробе воды. В результате кристаллогидраты CaSO4, MgSO4 превращаются в безводные формы. Дальнейшие действия заключаются в выпаривании чашки с содой, чтобы извлечь воду из кристаллогидратов Na2SO4.
Что может ТДС?
Прибор TDS (Total Dissolved Solids) – это измеритель общего количества растворенных в воде частиц солей на 1 миллион частиц воды. По принципу действия TDS – обычный кондуктометр, измеряющий электропроводимость растворов.
Соли, растворяясь в воде, распадаются на ионы, которые электрически заряжены. Чем больше в растворе заряженных частиц, тем выше его способность проводить электрический ток.
Поэтому по электропроводимости раствора можно судить о концентрации солей в нем.
TDS-метр покажет:
- уровень общей минерализации в единицах измерениях PPM (parts per million);
- превышение содержания солей или их отсутствие.
Этим прибором не получится проверить безопасность воды и сделать выводы о ее качестве. TDS-метр «не видит» вещества, растворенные в воде, если растворы этих веществ неэлектролиты. Именно поэтому датчик прибора не зафиксирует присутствие в воде токсичного хлороформа, но просигнализирует о непригодности безопасной минеральной воды проверенного бренда.
TDS-метр незаменим, если надо принять решение о целесообразности установки для очистки воды методом обратного осмоса. Прибором удобно замерить минерализацию поступающей воды и убедиться, что солей много (или мало).
А затем TDS-метр пригодится для определения качества работы системы очистки осмосом. Измерение параметра минерализации воды до фильтра и после него позволят сделать вывод о необходимости замены мембраны.
Физические и физико-химические свойства
Температура плавления +800,8 °С, кипения +1465 °С.
Умеренно растворяется в воде, растворимость мало зависит от температуры: коэффициент растворимости NaCl (в граммах на 100 г воды) равен 35,9 при +21 °C и 38,1 при +80 °C. Растворимость хлорида натрия существенно снижается в присутствии хлороводорода, гидроксида натрия, солей — хлоридов металлов. Растворяется в жидком аммиаке, вступает в реакции обмена. В чистом виде хлорид натрия не гигроскопичен. Однако соль часто бывает загрязнена примесями (преимущественно ионами Ca2+, Mg2+ и SO2−4), и такая соль на воздухе сыреет. Кристаллогидрат NaCl · 2H2O можно выделить при температуре ниже +0,15 °C.
Смесь измельчённого льда с мелким порошком хлорида натрия является эффективным охладителем. Так, смесь состава 30 г NaCl на 100 г льда охлаждается до температуры −20 °C. Это происходит потому, что водный раствор соли замерзает при температуре ниже 0 °C. Лёд, имеющий температуру около 0 °C, плавится в таком растворе, поглощая тепло окружающей среды.
| Термодинамические характеристики | |
|---|---|
| ΔfHg | −181,42 кДж/моль |
| ΔfHl | −385,92 кДж/моль |
| ΔfHs | −411,12 кДж/моль |
| ΔfHaq | −407 кДж/моль |
| Sg, 1 bar | 229,79 Дж/(моль·K) |
| Sl, 1 bar | 95,06 Дж/(моль·K) |
| Ss | 72,11 Дж/(моль·K) |
Диэлектрическая проницаемость NaCl — 6,3
Плотность и концентрация водных растворов NaCl
| Концентрация, % | Концентрация, г/л | Плотность, г/мл |
|---|---|---|
| 1 | 10,05 | 1,005 |
| 2 | 20,25 | 1,012 |
| 4 | 41,07 | 1,027 |
| 6 | 62,47 | 1,041 |
| 8 | 84,47 | 1,056 |
| 10 | 107,1 | 1,071 |
| 12 | 130,2 | 1,086 |
| 14 | 154,1 | 1,101 |
| 16 | 178,5 | 1,116 |
| 18 | 203,7 | 1,132 |
| 20 | 229,5 | 1,148 |
| 22 | 256 | 1,164 |
| 24 | 283,2 | 1,18 |
| 26 | 311,2 | 1,197 |
Дефицит
Причины гипонатриемии:
- недостаточное поступление соли с пищей (менее 0,5 грамм);
- цирроз печени с асцитом;
- поликистоз почек;
- пиелонефрит;
- декомпенсированный сахарный диабет;
- хроническая почечная недостаточность;
- нефротический синдром;
- заболевания пищеварительного тракта;
- прием мочегонных средств;
- гиперсекреция антидиуретического гормона .
Симптомы недостатка:
- снижение тургора кожи;
- сухость дермы;
- судороги в ногах;
- рвота;
- жажда;
- уменьшение выделения мочи;
- тошнота;
- спутанность сознания, галлюцинации;
- потеря аппетита;
- сонливость и апатия;
- потеря веса;
- мышечная слабость;
- частые инфекционные заболевания
- снижение артериального давления .
Последствия:
- депрессия;
- ухудшение переваривания пищи;
- уменьшение объема плазмы крови;
- вымывание соли из костей;
- усиленное накопление вредных азотистых соединений, подрывающих здоровье;
- нарушение работы вестибулярного аппарата .
3.1. Почвеные запасы соли в Алтайском крае
Запасы поваренной соли в Алтайском крае практически полностью покрывают необходимые запросы населения. В основном это соленые озера Кулундинской степи, Славгородского, Бурлинского, Михайловского и ряда других районов края.
Озеро Бурлинское— бессточное солёное озеро в Славгородском районе Алтайского края, расположено в западной части Кулундинской равнины, в 18 км к северо–западу от города Славгород. Площадь озера — 31,3 км2, средняя глубина меньше 1 метра, максимальная глубина достигает 2,5 м. Под слоем ила толщиной до 0,5 м залегает мощный слой глауберовой соли.
Зимой (с ноября по март) обычно наблюдается подъём уровня озера. Это связано не только с притоком подземных вод при отсутствии испарения, но и с отсутствием ледяного покрова, так как твердые атмосферные осадки, попадая в солёное озеро, превращаются в воду. Вода в озере солёная и является крупнейшим месторождением поваренной соли в Западной Сибири. Запасы поваренной соли в Бурлинском озере составляют около 30 млн. т.
Кучу́кское о́зеро (Кучук)— горько–солёное озеро в Благовещенском районе Алтайского края на Кулундинской равнине, второе по величине озеро Алтайского края после Кулундинского, расположенного в 6 км севернее. Площадь 181 км2, длина 19 км, ширина 12 км, наибольшая глубина 3,3 м. Питание снеговое; зимой не замерзает.
Кучукское озеро имеет заиленное дно, на середине покрытое слоем мирабилита. Средняя мощность пласта кристаллического сульфата натрия на дне 2,5 м, с запасами в десятки миллионов тонн поваренной соли, хлористого магния. В 1960 году вблизи озера создано крупное предприятие химической отрасли Кучуксульфат. Запасы поваренной соли в Кучукском озере составляют 56,8 млн. т.
Малиновое— озеро в Михайловском районе Алтайского края 10 км южнее села Михайловское. Это бессточное, горько–солёное озеро. Оно относится к группе Михайловских озёр (Танатар). Озеро уникально цветом воды малинового оттенка, отчетливый розово–малиновый оттенок воде придаёт особый вид мелких планктонных рачков, живущих в озере. Площадь озера 11,4 км2. На берегу расположен посёлок Малиновое Озеро, где работает химическое предприятие с использованием местного сырья.
Озеро Горькое расположено в системе озер Барнаульского ленточного бора в Новичихинском районе Алтайского края. Длина около 25 км, максимальная ширина – около 3,8 км. Озеро горько–соленое.
Промышленная добыча соли велась на Бурлинском озере, однако и она приостановлена с декабря 2009 года.
Каменная соль
Он представляет собой горную осадочную породу из группы эвапоритов, которая состоит более чем на 90 процентов из галита. Для каменной соли характернее белоснежный цвет, лишь в исключительных случаях присутствие глины дает минералу серый оттенок, а наличие оксидов железа придает соединению желтый, оранжевый цвет. В каменной соли присутствует не только хлорид натрия, но и множество иных химических соединений магния, кальция, калия:
- иодиды;
- бораты;
- бромиды;
- сульфаты.
В зависимости от условий формирования, основные месторождения каменной соли подразделяют на несколько видов:
- подземные соляные воды;
- рассолы современных бассейнов;
- залежи минеральных солей;
- ископаемые месторождения.
Передозировка
При передозировке пациент может чувствовать тошноту, страдать от рвоты и диареи, у него могут развиваться боли в животе, лихорадка, учащенное сердцебиение. Также при передозировке могут повышаться показатели , развиваться отек легких и периферические отеки, почечная недостаточность, судороги мышц, слабость, генерализованные судороги, кома. При чрезмерном введении раствора может развиться гипернатриемия.
При чрезмерном поступлении в организм может развиться гиперхлоримический ацидоз.
Если натрия хлорид применяется для растворения лекарств, то в основном передозировка связана со свойствами тех препаратов, которые подвергаются разведению.
При непреднамеренном избыточном введении NaCl важно прекратить этот процесс и оценить, есть ли негативнее симптомы у пациента. Практикуется симптоматическое лечение
Фармакологическое действие
Хлористый натрий используется в качестве дезинтоксикационного, регидратационного и плазмозамещающего средства. Его применение сопровождается следующими эффектами:
- нормализация баланса воды и соли;
- восполнение нехватки Na и Cl;
- временное повышение объёма крови;
- увеличение мочеотделения для очищения организма.
Благодаря улучшению биодоступности большинства лекарственных средств, солевой раствор используется в медицине в качестве средства для разведения инъекционных и инфузионных препаратов.
Он несовместим или плохо совместим со следующими лекарствами:
- норадреналин;
- кортикостероиды;
- стимулятор лейкопоэза Филграстим;
- антибиотик Полимиксин В.
Физиологический раствор обладает осмотическим давлением, аналогичным кровяной среде человека, поэтому быстро выводится из организма. Уже через 1 час после применения капельницы в организме остаётся менее половины средства.