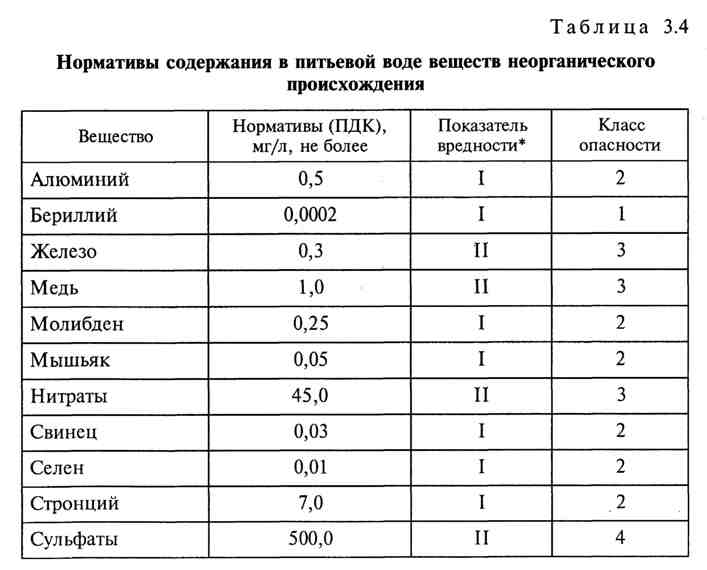
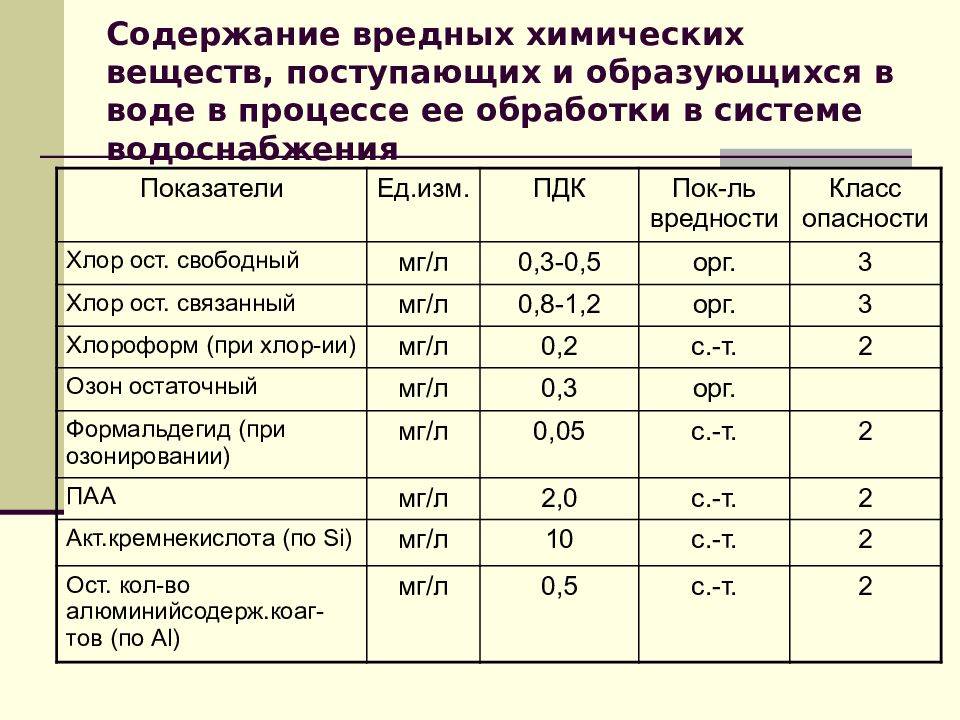
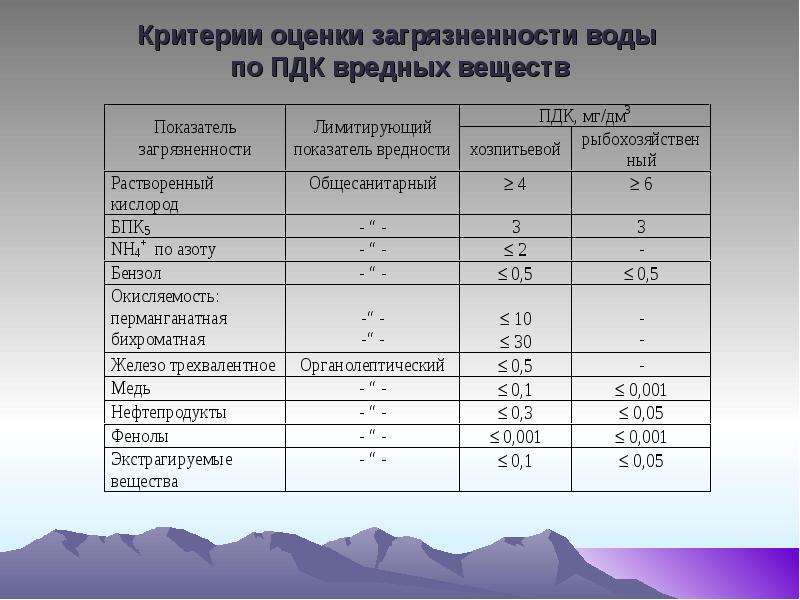
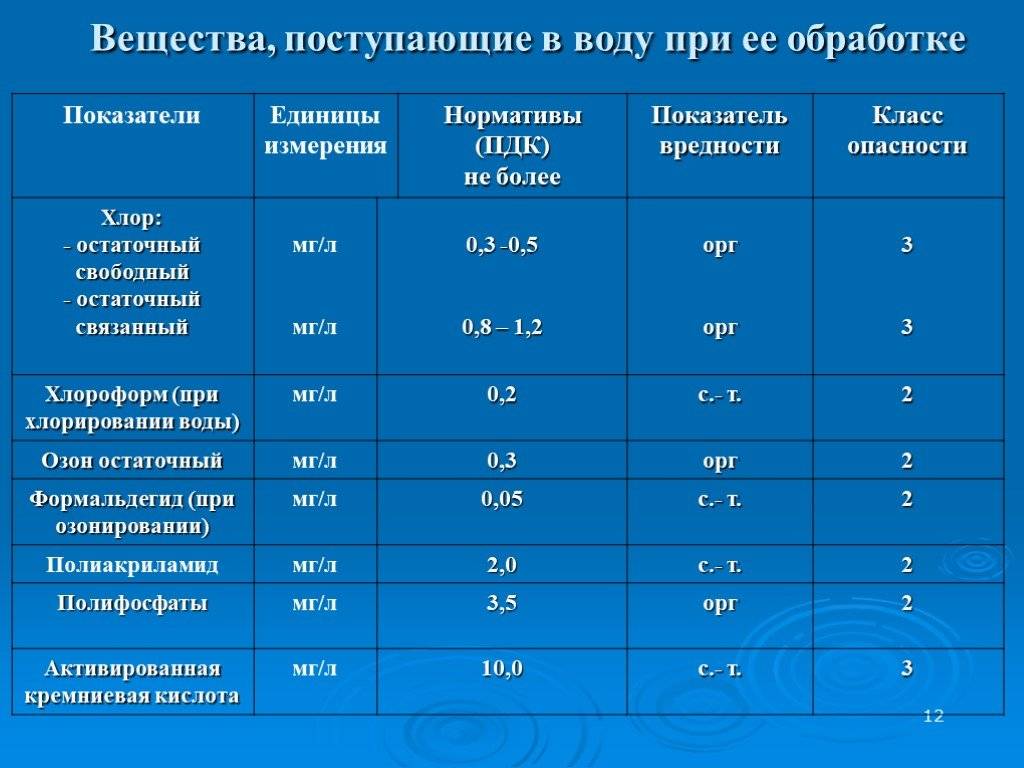
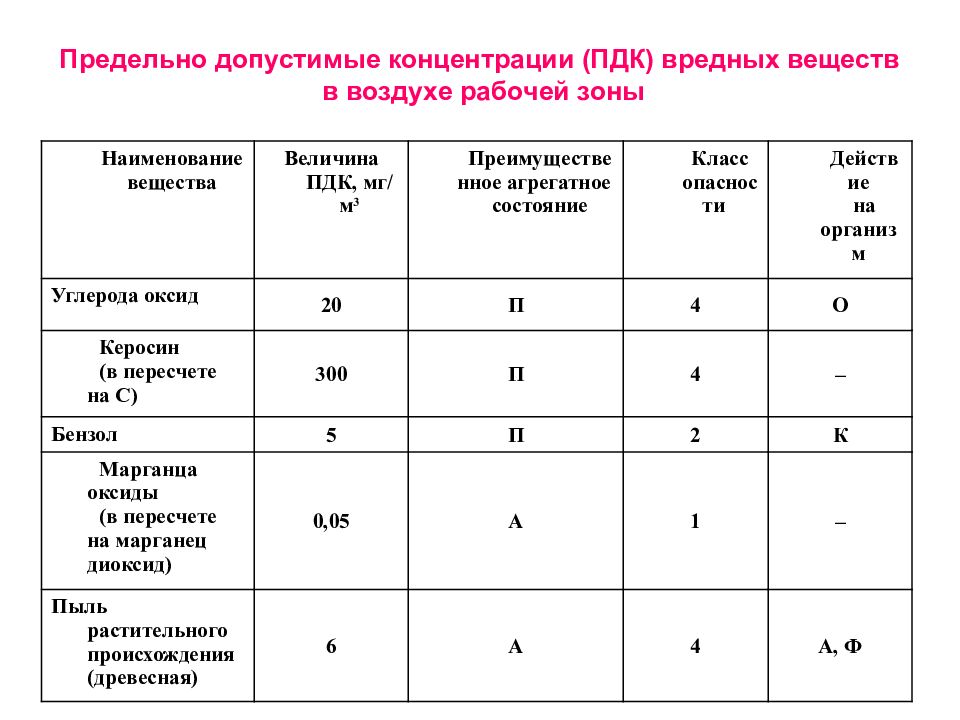
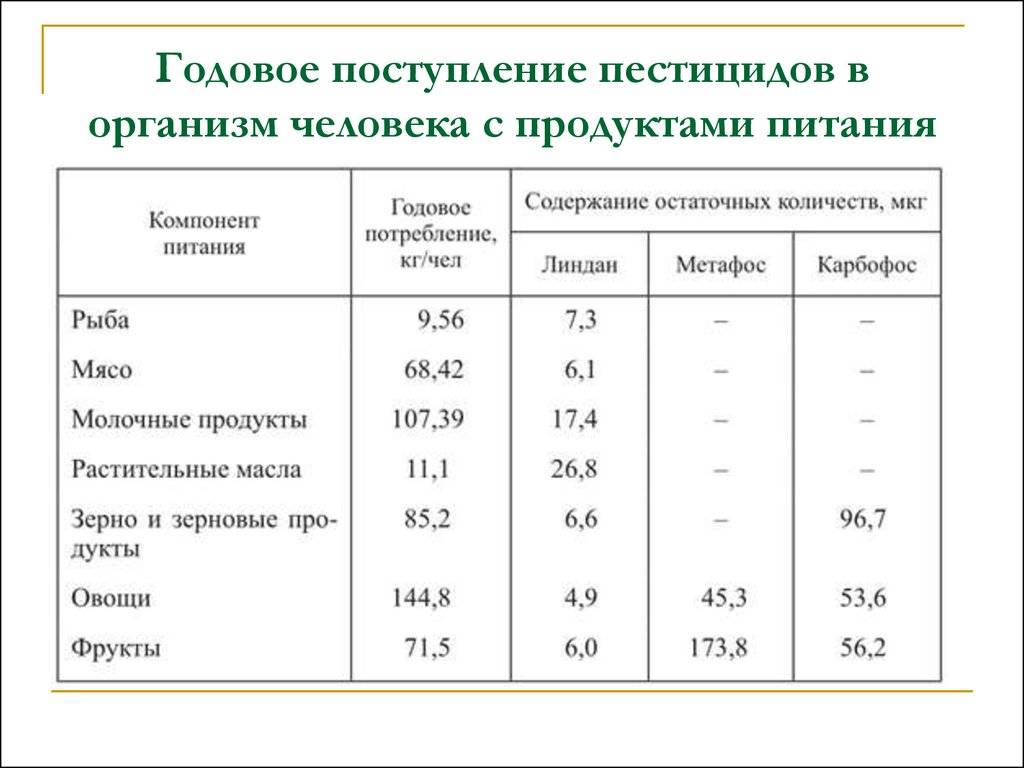
3.3. Требования к устройству шахтных колодцев
3.3.1. Шахтные колодцы предназначены для получения подземных вод из первого от поверхности безнапорного водоносного пласта. Такие колодцы представляют собой шахту круглой или квадратной формы и состоят из оголовка, ствола и водоприемной части.
При невозможности соблюдения этого расстояния место расположения водозаборных сооружений в каждом конкретном случае согласуется с центром государственного санитарно-эпидемиологического надзора.
3.3.2. Оголовок (надземная часть колодца) служит для защиты шахты от засорения и загрязнения, а также для наблюдения, водоподъема, водозабора и должен иметь не менее чем на 0,7 – 0,8 м выше поверхности земли.
3.3.3. Оголовок колодца должен иметь крышку или железобетонное перекрытие с люком, также закрываемое крышкой. Сверху оголовок прикрывают навесом или помещают в будку.
3.3.5. Ствол (шахта) служит для прохода водоподъемных приспособлений (ведер, бадей, черпаков и т.п.), а также в ряде случаев и для размещения водоподъемных механизмов. Стенки шахты должны быть плотными, хорошо изолирующими колодец от проникновения поверхностного стока, а также верховодки.
3.3.8. Водоприемная часть колодца служит для притока и накопления грунтовых вод. Ее следует заглублять в водоносный пласт для лучшего вскрытия пласта и увеличения дебита. Для обеспечения большого притока воды в колодец нижняя часть его стенок может иметь отверстия или устраиваться в виде шатра.
3.3.9. Для предупреждения выпирания грунта со дна колодца восходящими потоками грунтовых вод, появления мути в воде и облегчения чистки на дне колодца должен быть отсыпан обратный фильтр.
3.3.10. Для спуска в колодец при ремонте и очистке в стенки его должны заделываться чугунные скобы, которые располагаются в шахматном порядке на расстоянии 30 см друг от друга.
3.3.11. Подъем воды из шахтных колодцев осуществляется с помощью различных приспособлений и механизмов. Наиболее приемлемым с гигиенической точки зрения является использование насосов различных конструкций (ручных и электрических). При невозможности оборудования колодца насосом допускается устройство ворота с одной или двумя ручками, ворота с колесом для одной или двух бадей, «журавля» с общественной, прочно прикрепленной бадьей и др. Размер бадьи должен примерно соответствовать объему ведра, чтобы переливание воды из нее в ведра не представляло затруднений.
Кадмий (Cd)
Загрязнение кадмием может возникнуть во время выщелачивания почв, при разложения разных микроорганизмов которые его накапливают, а также из-за миграции из медных и полиметаллических руд.
Человек тоже виноват в загрязнении этим металлом. Сточные воды с разных предприятий занимающеюся рудообогащением, гальваническим, химическим, металлургическим производством могут содержать большие количества соединений кадмия.
Естественные процессы по снижению уровня соединений кадмия являются сорбция, его потребление микроорганизмами и выпадение в осадок малорастворимого карбоната кадмия.
В растворе, кадмий находится, как правило, в форме органо-минеральных и минеральных комплексов. Сорбированные вещества на базе кадмия – важнейшие взвешенные формы этого элемента. Очень важна миграция кадмия в живых организмов (гидробиониты).
Содержание кадмия в природных водоёмах
Уровень кадмия в чистых реках и озерах колеблется на уровне меньше микрограмма на литр, в загрязнённых водах уровень этого элемента доходит до нескольких микрограммов на литр.
Некоторые исследователи считают, что кадмий, в малых количествах, может быть важным для нормального развития животных и человека. Повышенные концентрации кадмия очень опасных для живых организмов.
Тяжелые металлы, загрязняющие почву
Существует три класса опасности тяжелых металлов. Всемирная организация здравоохранения самыми опасными считает заражение свинцом, ртутью и кадмием. Но не менее вредна и высокая концентрация остальных элементов.
Ртуть
Загрязнение почвы ртутью происходит с попаданием в нее пестицидов, различных бытовых отходов, например люминесцентных ламп, элементов испорченных измерительных приборов.

По официальным данным годовой выброс ртути составляет более пяти тысяч тонн. Ртуть может поступать в организм человека из загрязненной почвы.
Если это происходит регулярно, могут возникнуть тяжелые расстройства работы многих органов, в том числе страдает и нервная система.
При ненадлежащем лечении отравления ртутью возможен летальный исход.
Свинец
Очень опасным для человека и всех живых организмов является свинец.
Он чрезвычайно токсичен. При добыче одной тонны свинца двадцать пять килограммов попадает в окружающую среду. Большое количество свинца поступает в почву с выделением выхлопных газов.
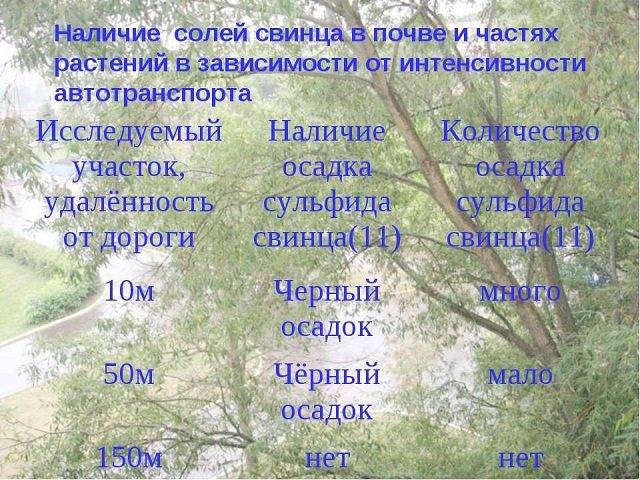
Зона загрязнения почвы вдоль трасс составляет свыше двухсот метров вокруг. Попадая в почву, свинец поглощается растениями, которые употребляют в пищу человек и животные, в том числе и скот, мясо которого также присутствует в нашем меню. От избытка свинца поражается центральная нервная система, головной мозг, печень и почки. Он опасен своим канцерогенным и мутагенным действием.
Кадмий
Огромной опасностью для организма человека является загрязнение почвы кадмием. Попадая в пищу, он вызывает деформацию скелета, остановку роста у детей и сильные боли в спине.
Медь и цинк
Высокая концентрация в почве этих элементов становится причиной того, что замедляется рост и ухудшается плодоношение растений, что приводит в конечном итоге к резкому уменьшению урожайности. У человека происходят изменения в мозге, печени и поджелудочной железе.
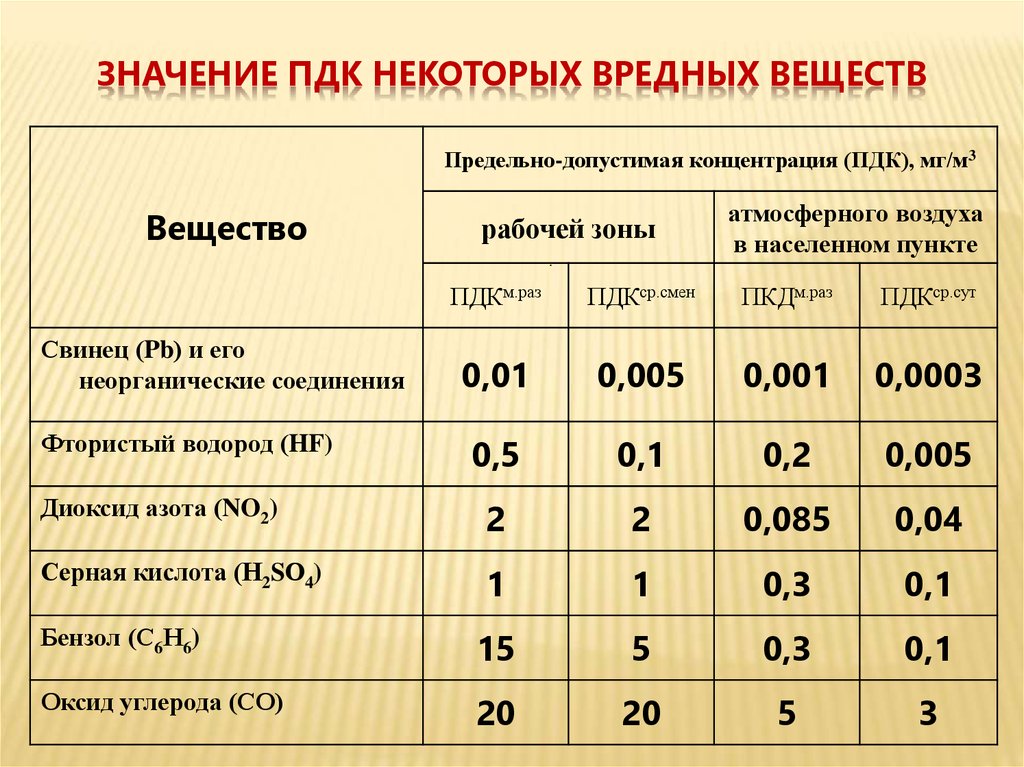
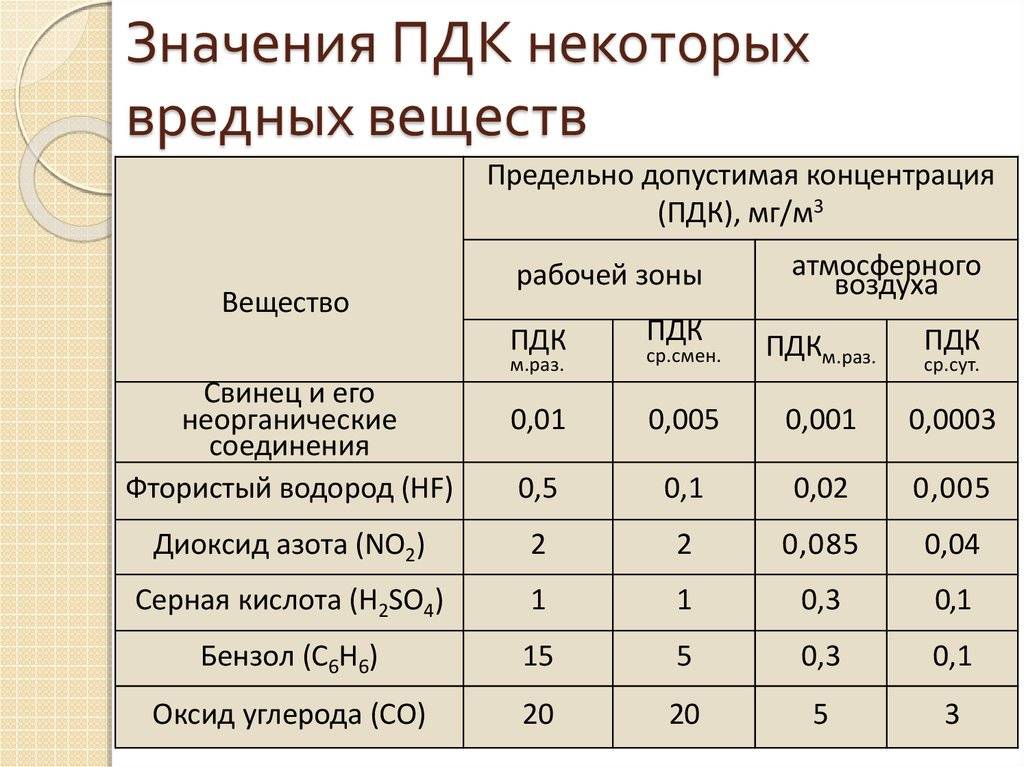
Нормативные документы, содержащие нормы ПДК
Допустимые нормы ПДК содержатся в различных ГОСТах и актах, выпущенных органами санитарно-эпидемиологического надзора. Некоторые из них были созданы еще в советское время и с того момента не пересматривались, другие корректировались и издавались в ходе последних 20 лет.
Среди наиболее важных документальных источников стоит упомянуть следующие:
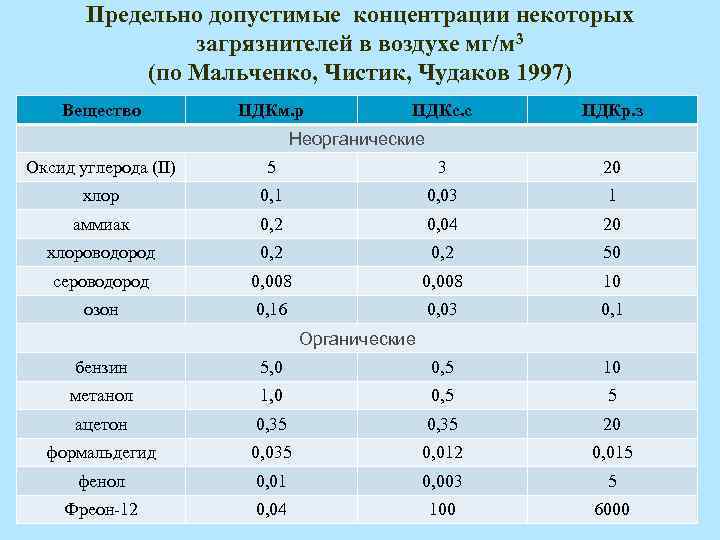
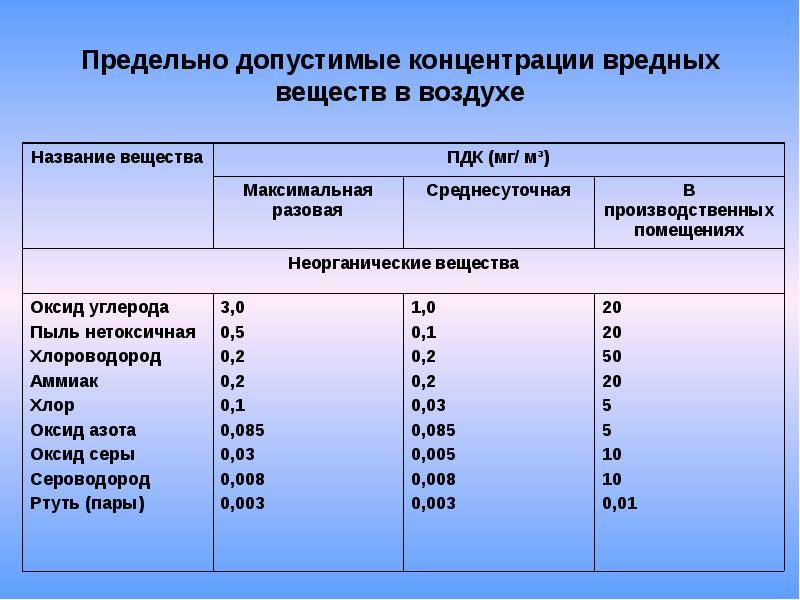
- ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест».
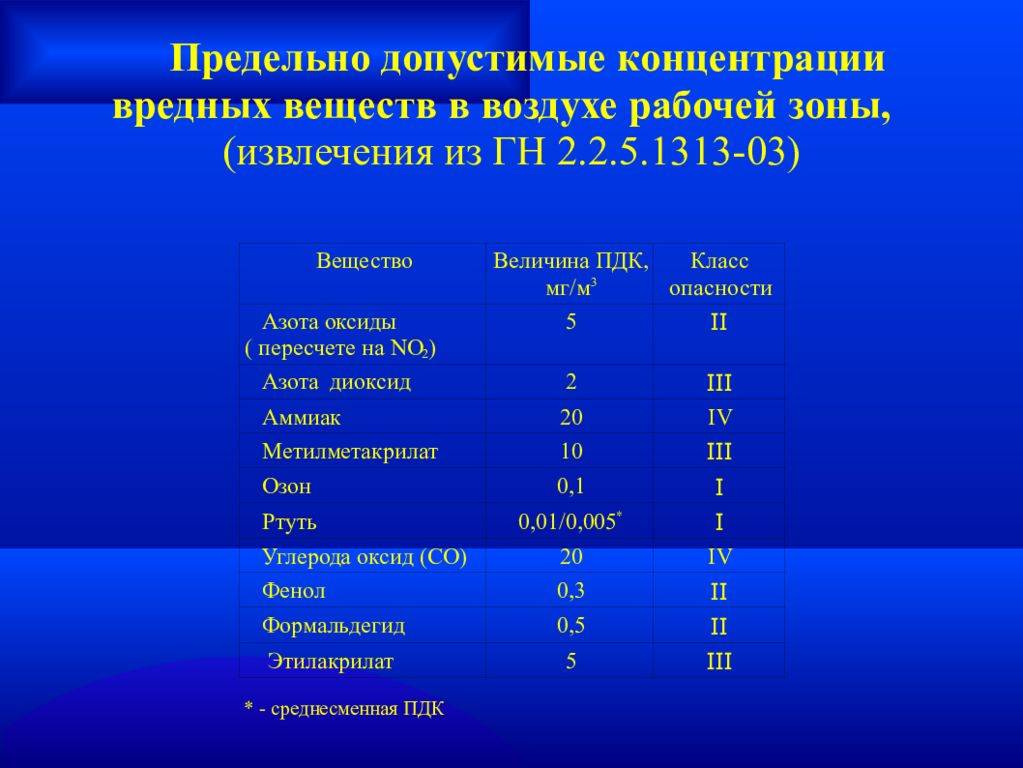
- ГН 2.2.5.1313-03 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны».
- ГН 2.2.5.1827-03 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны (Дополнение №1 к ГН 2.2.5.1313-03)».
- ГОСТ 12.1.005-88 «ПДК вредных газов, паров и аэрозолей в воздухе рабочей зоны».
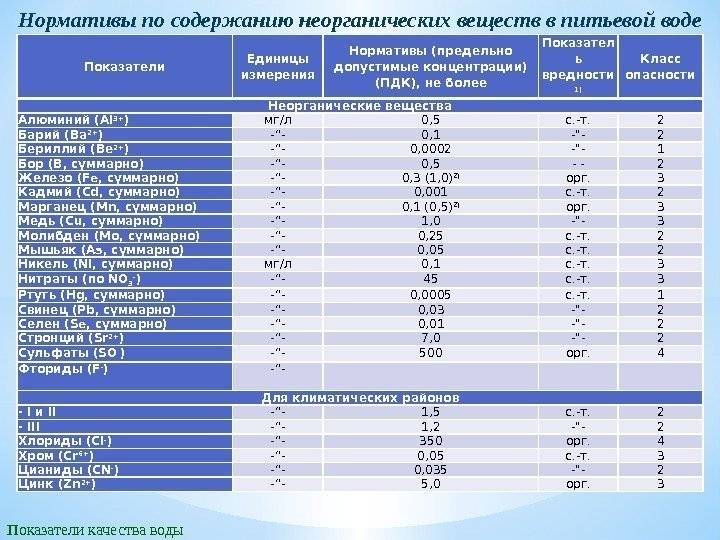
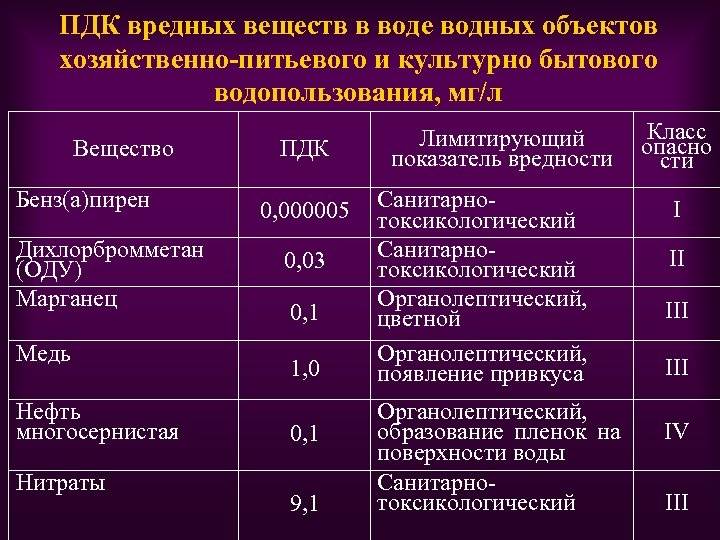
- ГН 2.1.5.1315-03 «Предельно допустимые концентрации (ПДК) химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования».
- ГН 2.3.3.972-00 «Предельно допустимые количества химических веществ, выделяющихся из материалов, контактирующих с пищевыми продуктами».
Существуют также дополнительные нормативные акты, регламентирующие ПДК конкретных типов веществ (например, дибензоидоксинов). Они имеют более узкую направленность и применяются при взятии проб на определенных промышленных объектах.
Превышать нормы, указанные в документах экологического права, не может нарушать ни одно предприятие и другой промышленный объект. За нарушения режима безопасности предусмотрена система штрафов.
Основные методы борьбы с загрязнением почв тяжелыми металлами
Методы борьбы с загрязнением почвы тяжелыми металлами могут быть физическими, химическими и биологическими. Среди них можно выделить следующие способы:
- Увеличение кислотности почвы повышает возможность загрязнения ее тяжелыми металлами. Поэтому внесение органических веществ и глины, известкование помогают в какой-то мере в борьбе с загрязнением.
- Посев, скашивание и удаление с поверхности почвы некоторых растений, например клевера, существенно снижает концентрацию тяжелых металлов в почве. К тому же данный способ является совершенно экологичным.
- Проведение детоксикации подземных вод, ее откачивание и очистка.
- Прогнозирование и устранение миграции растворимой формы тяжелых металлов.
- В некоторых особо тяжелых случаях требуется полное снятие почвенного слоя и замена его новым.
Источники загрязнения воды
Источники загрязнения воды органическими веществами можно условно разделить на две группы:
- источники природного происхождения
- источники, связанные с хозяйственной деятельностью человека
К первым относятся органические соединения, входящие в состав почвы, а также образующиеся при разложении растительных и животных остатков и т.п.
То, что синтетические органических вещества попадают в питьевую воду – прямой результат человеческой деятельности. Главные «загрязнители» это:
сбросы предприятий
Особую опасность представляют нефтеперерабатывающие заводы, фабрики по производству изделий из меха и кожи, где используют дубильные вещества.
- остатки удобрений
- отходы животноводческих хозяйств
- моющие средства
- бытовые стоки
Загрязнение воды органическими веществами также способствует размножению там патогенных микроорганизмов. Поэтому такая вода непригодна для питья и приготовления пищи.

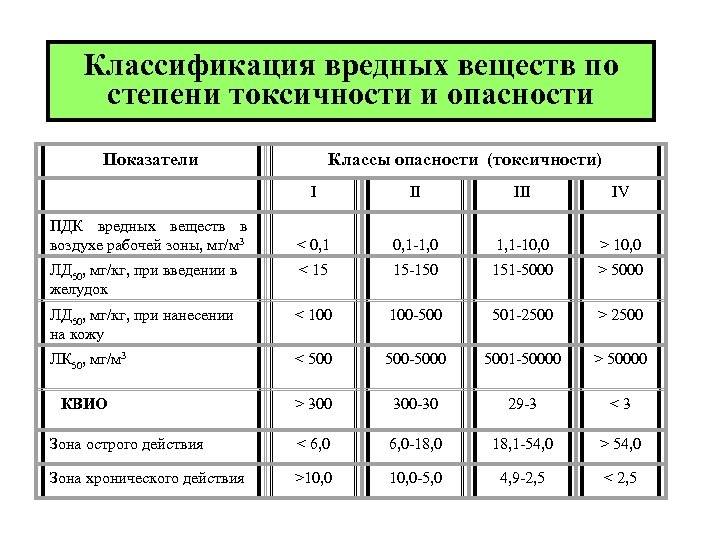
По степени опасности ТМ подразделяют на три группы:
1) высоко опасные: Hg, As, Se, Сd, РЬ, Zn; 2) умеренно опасные: Сг, Со, Мо, Ni, Си, Sb и 3) малоопасные: V, W, Мп, Sr. По свойствам ионов ТМ в воде данные элементы подразделяются на металлы, изменяющие органолептические свойства воды, такие как цвет, запах, вкус (Те, Мп, Zn) и токсикологические (Al, Cd, Си, Мо, Сг). Также существует классификация ТМ по степени подвижности в почвенных экосистемах: первый класс включают Hg, As, Se, Сd, Pb, Zn и второй класс Cr, Со, Мо, Ni, Cu, Sb. Оба класса относятся к металлам первичного рассеивания (такого, как вулканическая деятельность). К третьему классу относятся металлы вторичного рассеивания: V, W, Мп, Sr .
Методы борьбы с загрязнением почвы тяжелыми металлами могут быть физическими, химическими и биологическими.
Промышленные загрязнители
Состав наиболее опасных стоков – производственных – отличается разнообразностью и зависит от сферы промышленности, технологических процессов и сырья. Основными загрязнителями производственных СВ являются взвешенные вещества и нефтепродукты.
В СВ черной и цветной металлургии обычно обнаруживается высокая концентрация:
- взвешенных минеральных веществ;
- металлы;
- сульфаты;
- хлориды;
- смолы и масла;
- серная кислота.

В стоках нефтеперерабатывающей промышленности и нефтепромысла:
- нефть и нефтепродукты;
- хлориды;
- взвешенные вещества.
На коксохимических предприятиях, кроме взвешенных веществ, образуются:
- смолы;
- масла;
- неорганические кислоты;
- фенолы;
- аммиак;
- цианиды.
Отличаются сильной загрязненностью стоки целлюлозно-бумажных комбинатов, включающие примеси растворенной органики, каолина и волокон.
СВ предприятий автопрома:
- смесь нефтепродуктов;
- окалины;
- масла;
- цианиды;
- хром.
В стоках текстильных предприятий содержатся красители, синтетические поверхностно-активные вещества (ПАВ).
Все эти загрязнения специфические, поэтому должны удаляться до смешения с водами других предприятий или населенного пункта на локальных очистных сооружениях в месте образования.
Если грубодисперсные компоненты минеральной природы поступят на ступень биологической очистки, зольность активной биомассы будет возрастать. Это приведет к замедлению образования новых клеток, нарушению оптимального баланса по нагрузке между субстратом и микрофлорой.
Мышьяк (As)
Загрязнены мышьяком в основном районы, которые находятся близко к минеральным рудников с высоким содержанием этого элемента (вольфрамовые, медно-кобальтовые, полиметаллические руды). Очень малое количество мышьяка может произойти при разложении живых организмов. Благодаря водным организмам, он может усваиваться этими. Интенсивное усваивание мышьяка из раствора замечается в период бурного развития планктона.
Важнейшими загрязнителями мышьяком считаются обогатительная промышленность, предприятия по производству пестицидов, красителей, а также сельское хозяйство.
Озера и реки содержат мышьяк в два состояния: во взвешенном и растворённом. Пропорции между этими формами может меняться в зависимости от рН раствора и химической композиции раствора. В растворённом состоянии, мышьяк может быть трехвалентном или пятивалентном, входя в анионные формы.
Уровень мышьяка в природных водоёмах
В реках, как правило, содержание мышьяка очень низкое (на уровне мкг/л), а в морях – в среднем 3 мкг/л. Некоторые минеральные воды могут содержать большие количества мышьяка (до несколько миллиграммов на литр).
Больше всего мышьяка могут, содержат подземные водохранилища – до несколько десяток миллиграммов на литр.
Его соединения очень токсичны для всех животных и для человека. В больших количествах, нарушаются процессы окисления и транспорт кислорода к клеткам.
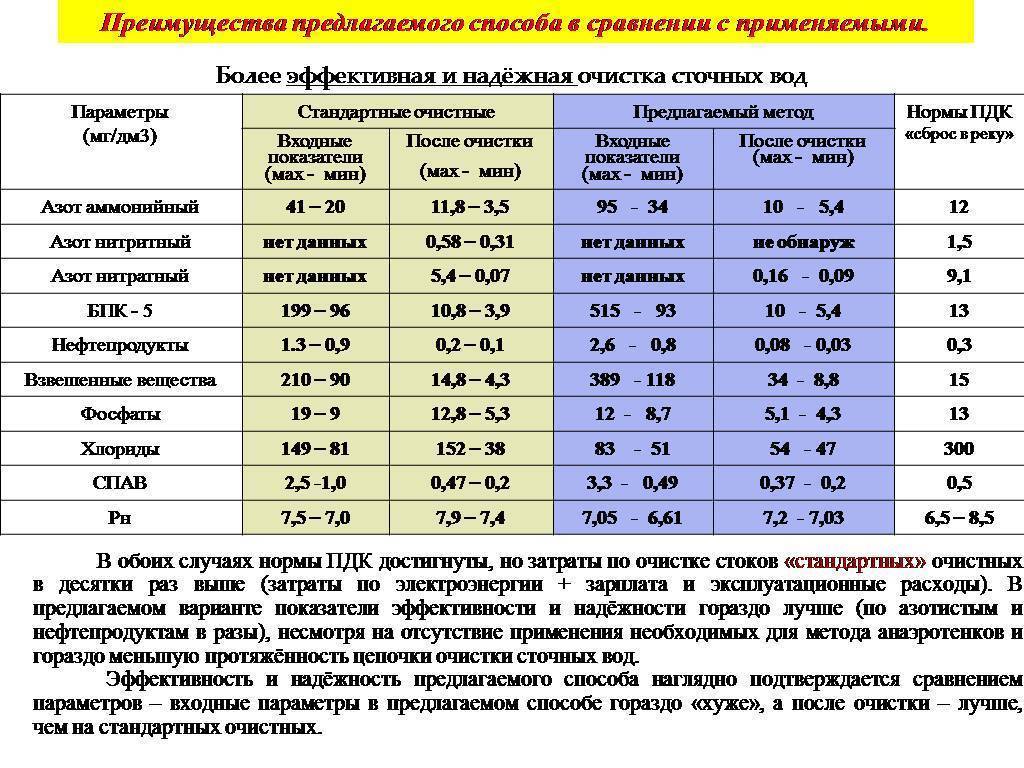
Расчет нормы сброса сточных вод
Стремительные темпы роста урбанизации требуют использования дополнительного объема водных ресурсов, которые возвращаются обратно уже в виде сточных вод. Конечный итог – это тотальное загрязнение водоемов, воду из которых уже невозможно будет использовать даже для технических нужд. Кроме того, грязные водоемы нарушают эстетический вид города, который сразу же становится грязным и неухоженным.
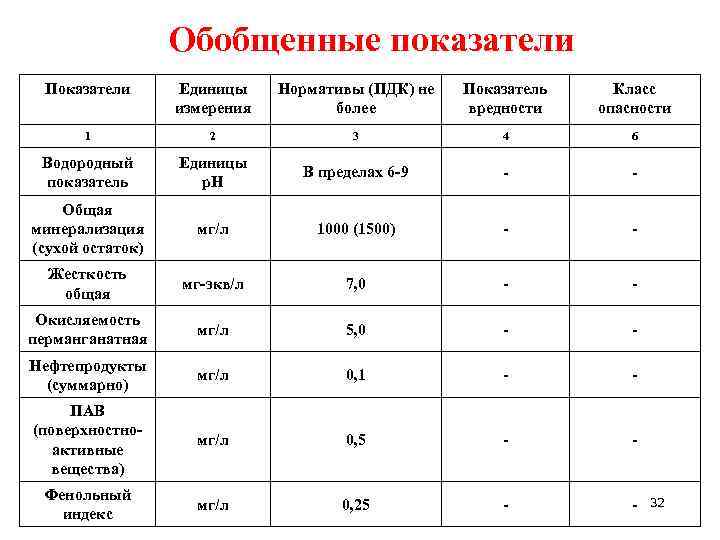
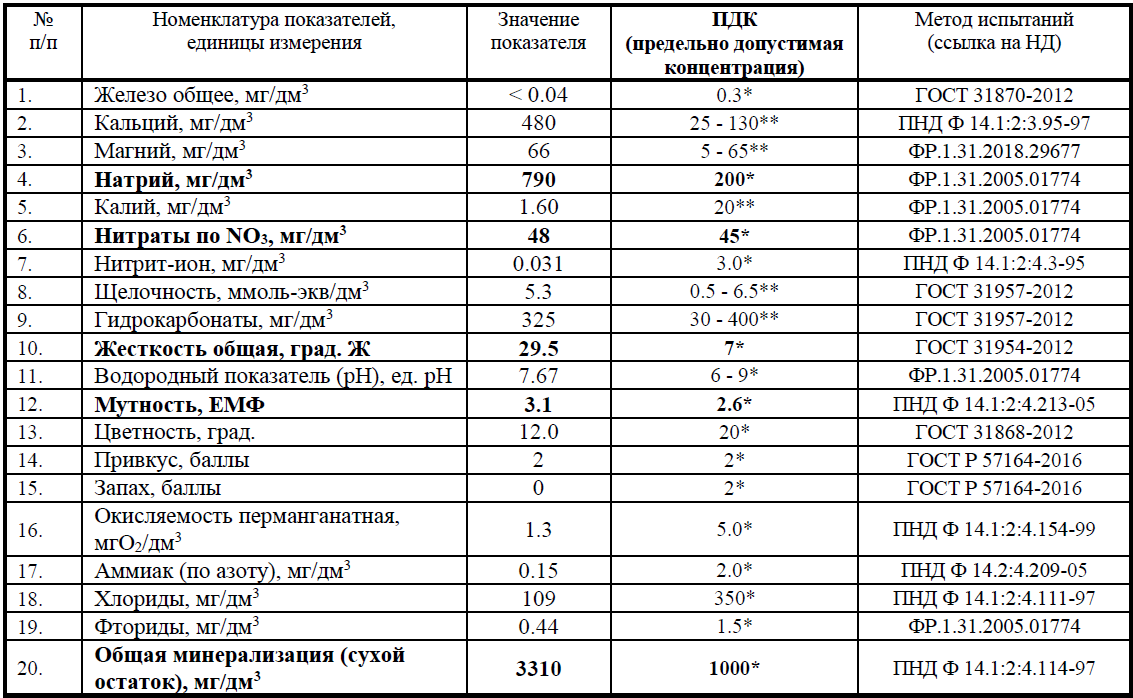
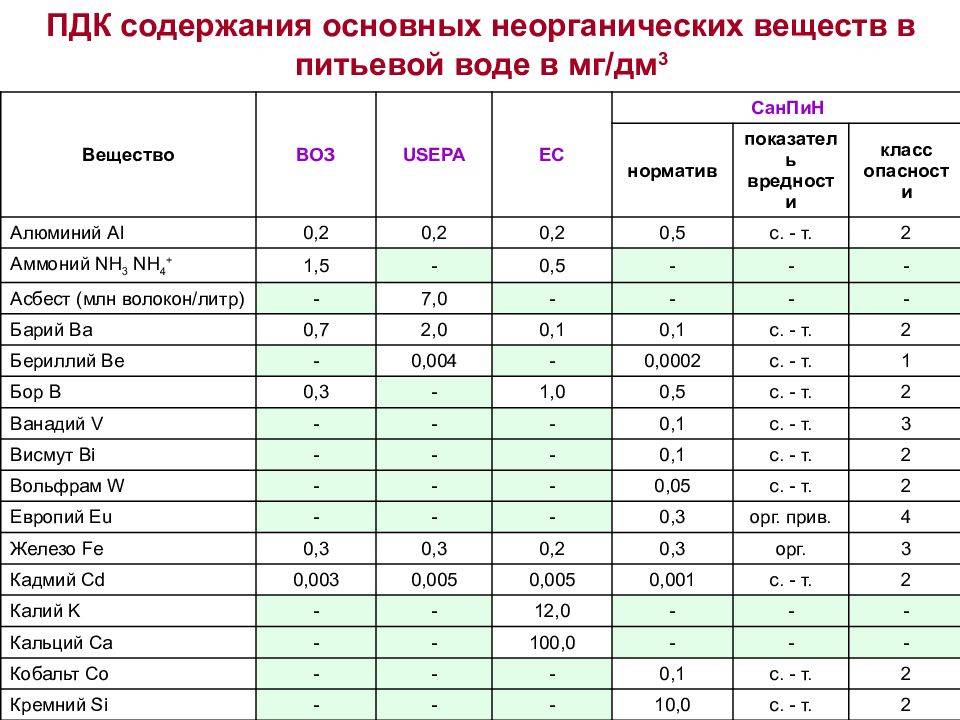
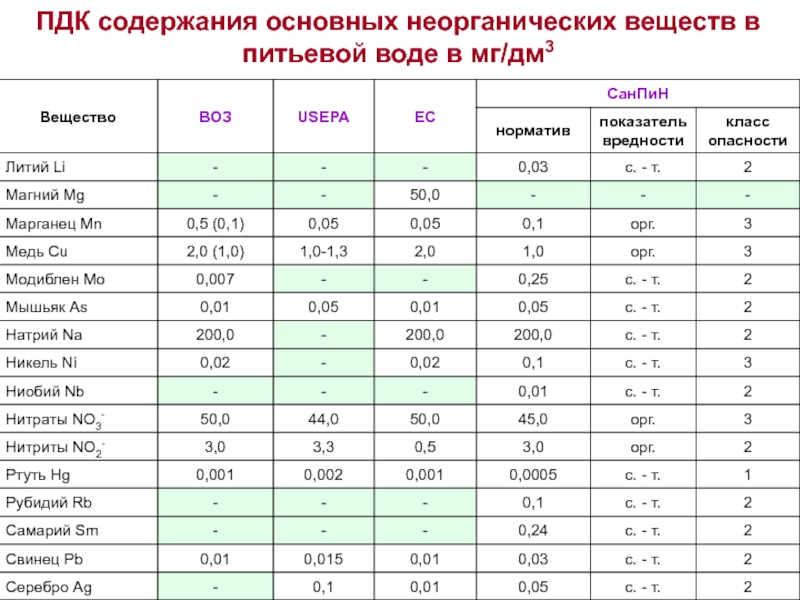
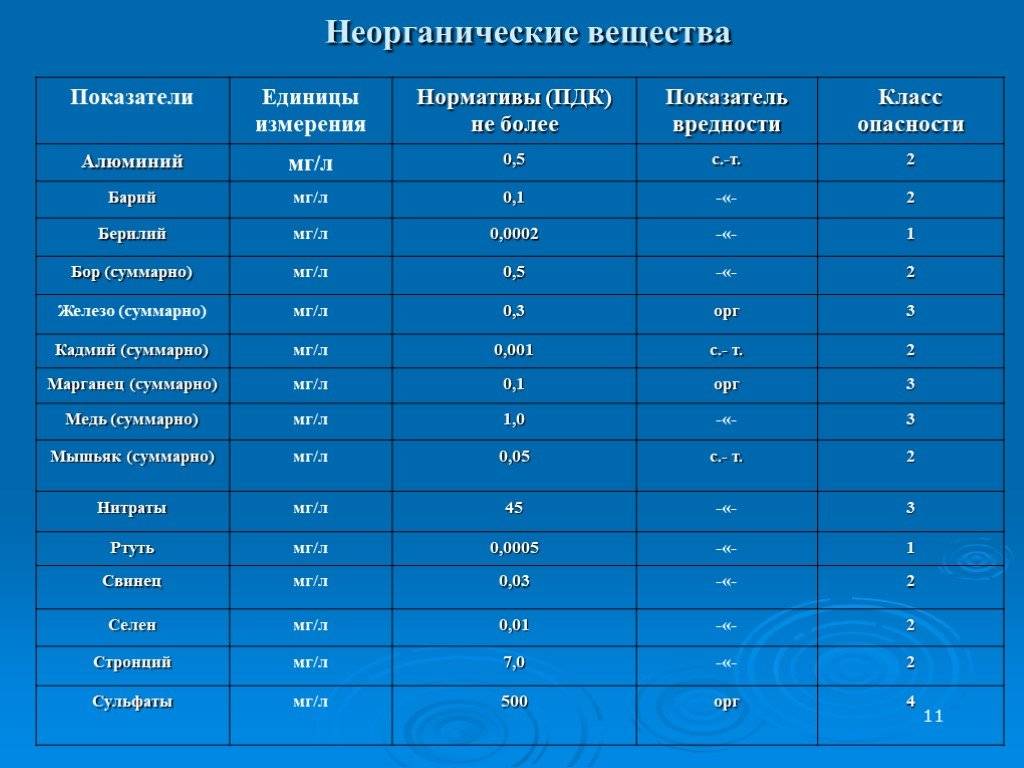
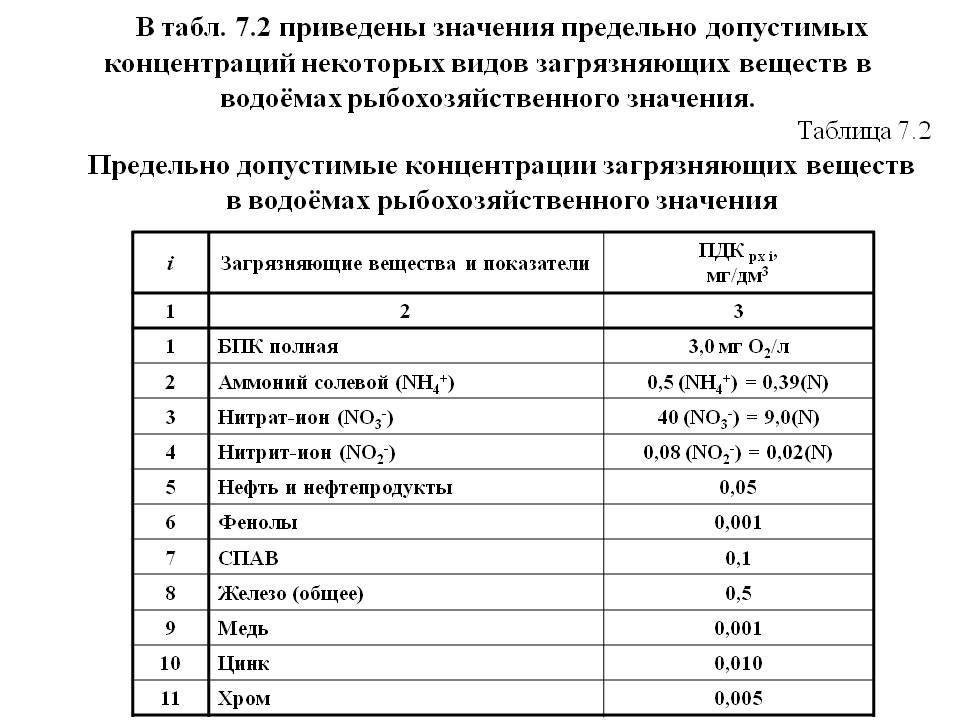
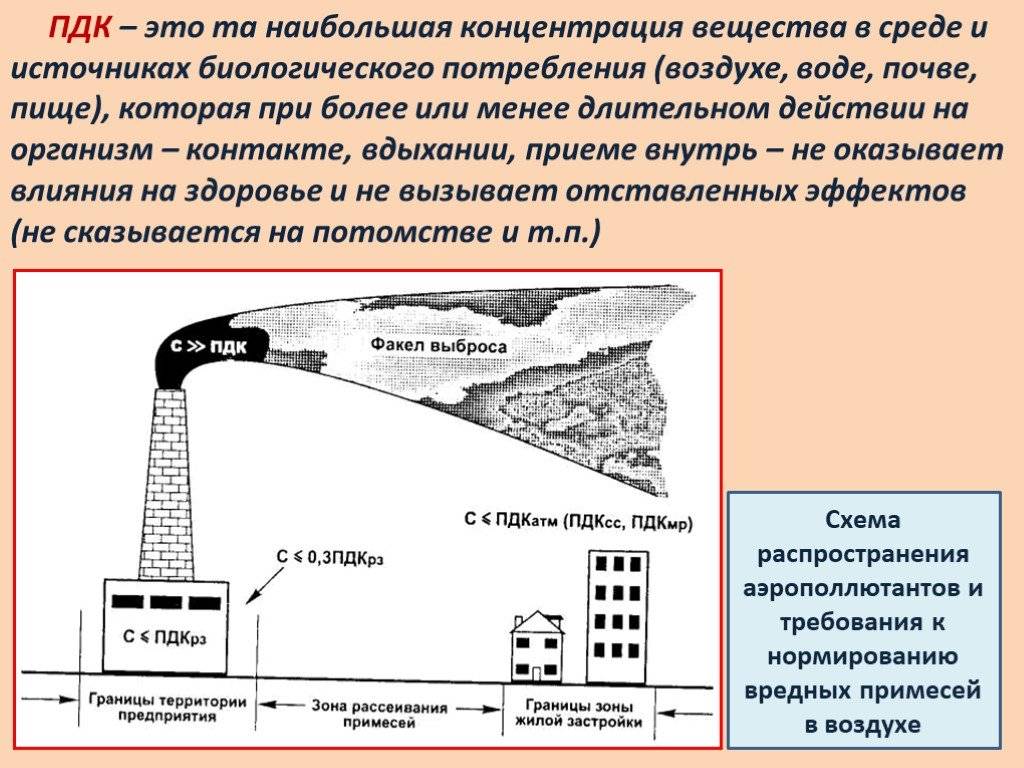
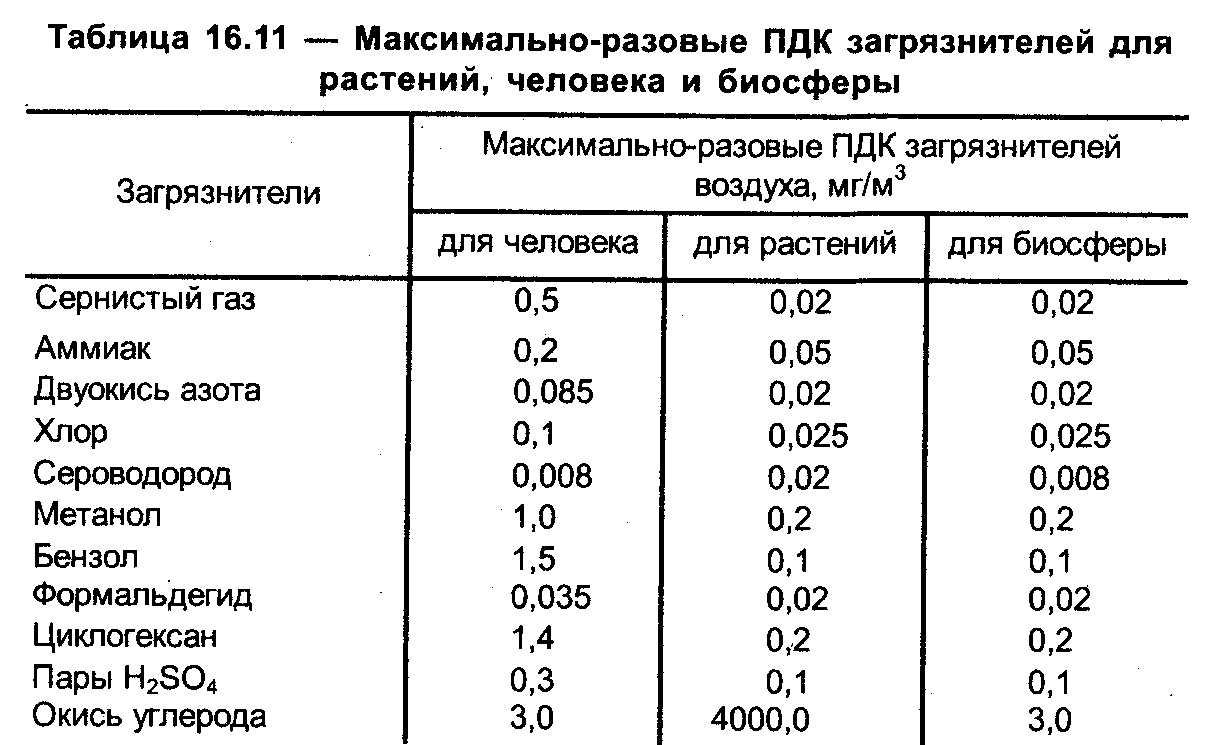
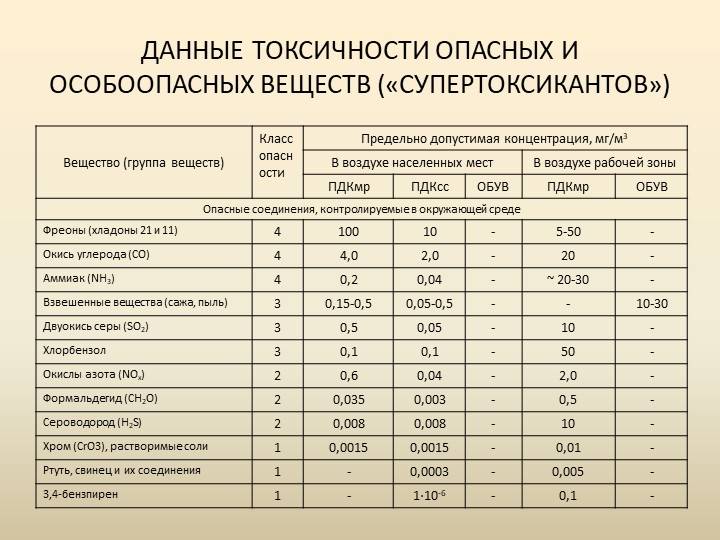
Допустимый уровень ПДК можно посмотреть в специальной таблице
Условно существует несколько методик избавления от сточных вод:
- Их непосредственный сброс в водоемы (для этих целей подбирается конкретное место);
- Утилизация в канализацию.
Большинство коммерческих предприятий работает на результат, поэтому не задумывается о грамотной утилизации использованной воды. На самом деле, проводить эти работы нужно в строгом соответствии с нормами СанПиН.
На основании полученных лабораторных исследований рассчитывается среднесуточный объем сточных вод, которые могут быть утилизированы без вреда для окружающей среды.
https://www.youtube.com/watch?v=YlLs0NfULTg
Периодически представитель контролирующего ведомства может посещать вверенное предприятие и брать пробы сточной воды. Если выяснится, что предприниматель превышает норму забора или использует некачественное оборудование для первичной очистки, ему придется заплатить солидный штраф и в обязательном порядке устранить нарушения. В противном случае деятельность придется свернуть.
Ртуть.
В окружающей среде соединения ртути с различной степенью окисления металла, то есть Hg(0), Hg(I), Hg(II), могут реагировать между собой. Наибольшую опасность представляют собой органические, прежде всего алкильные, соединения. Формы существования металлов в поверхностных водах Понижение токсичности (до 97%) – поверхностные воды океанов. Около половины всей ртути в природную среду попадает по техногенным причинам.
Кислотность среды и ее окислительный потенциал влияют на нахождение в водной среде той или иной формы ртути. Так, в хорошо аэрированных водоемах преобладают соединения Hg(II). Ионы ртути легко связываются в прочные комплексы с различными органическими веществами, находящимися в водах и выступающими в качестве лигандов. Особенно прочные комплексы образуются с серосодержащими соединениями. Ртуть легко адсорбируется на взвешенных частицах вод. При этом так называемый фактор концентрирования достигает порой 10 5, то есть на этих частицах сконцентрировано ртути в сто тысяч раз больше, чем находится в равновесии в водной среде. Отсюда следует, что судьба металла будет определяться сорбцией взвешенными частицами с последующей седиментацией, то есть по существу будет происходить удаление ртути из водной системы, как это уже было описано на примере образования залежей киновари в регионе Карпат. Следует отметить, что десорбция ртути из донных отложений происходит медленно, поэтому повторное загрязнение поверхностных вод после того, как источник загрязнения установлен и ликвидирован, также имеет заторможенную кинетику. В водных средах ртуть образует металлорганические соединения типа R–Hg–X и R–Hg–R, где R – метилили этил-радикал. Из антропогенных источников в водные системы ртуть попадает в виде преимущественно металлической ртути, ионов Hg(II) и ацетата фенилртути. Преобладающей формой ртути, обнаруживаемой в рыбе, является метилртуть, образующаяся биологическим путем с участием ферментов микроорганизмов. В не загрязненных поверхностных водах содержание ртути колеблется в пределах 0,2–0,1 мкг/л, в морских – в три раза меньше. Водные растения поглощают ртуть. Органические соединения R–Hg–R’ в пресноводном планктоне содержатся в большей концентрации, чем в морском. Из организма органические соединения ртути выводятся медленнее, чем неорганические. Существующий стандарт на предельное содержание этого токсиканта (0,5 мкг/кг) используют при контроле качества пищевых продуктов. При этом предполагают, что ртуть присутствует в виде метилированных соединений. При попадании в организм человека последних может проявиться болезнь Минимата.
Особенности распространения в природе самых токсичных металлов
Ртуть в природе более всего локализуется в водной и воздушной среде. В воды мирового океана ртуть поступает из промышленных сливов, также встречаются пары ртути, образующиеся вследствие горения угля. Токсичные соединения аккумулируются в живых организмах, особенно в морепродуктах.
Свинец имеет широкую область распространения. Он накапливается и в горах, и в почве, и в воде, и в живых организмах, и даже в воздухе, в виде выхлопных газов от автомобилей. Конечно, свинец поступает в окружающую среду и в результате антропологического действия в виде отходов от промышленной отрасли и неутилизированных отходов (аккумуляторы и батарейки).

А источником загрязнения окружающей среды кадмием являются сточные воды промышленных предприятий, а также природные факторы: выветривание медных руд, вымывание почв, а также результаты вулканической активности.
Какие воды загрязнены?
Важно понимать, что большинство солей тяжелых металлов попадают в окружающую среду антропогенным путем — в основном из выбросов добывающих и обрабатывающих предприятий, а также тепловых электростанций. Самым объемным источником загрязнения являются сточные воды, которые сливаются в поверхностные водоемы с недостаточным уровнем очистки
Следующим путем внесения тяжелых металлов являются дымовые газы, которые осаждаются на поверхность земли и смываются с нее в источники воды. И еще одним, пожалуй, самым серьезным типом загрязнения являются воды, которые образуются при затоплении шахтных выработок, в таком случае происходит загрязнение даже подземных вод
Самым объемным источником загрязнения являются сточные воды, которые сливаются в поверхностные водоемы с недостаточным уровнем очистки. Следующим путем внесения тяжелых металлов являются дымовые газы, которые осаждаются на поверхность земли и смываются с нее в источники воды. И еще одним, пожалуй, самым серьезным типом загрязнения являются воды, которые образуются при затоплении шахтных выработок, в таком случае происходит загрязнение даже подземных вод.
Максимальный риск отравления солями тяжелых металлов возникает при использовании воды с поверхностных водоемов и колодцев без последующей очистки. В тех случаях, когда загрязнены подземные воды, также не рекомендуется потребление воды из скважин. Прежде всего это касается промышленных регионов восточной Украины.
Загрязнение пищевых продуктов тяжелыми металлами
Пищевые цепочки – один из основных путей поступления токсикантов в организм. Они начинаются от сельхозугодий и заканчиваются человеком. Растения поглощают металлы из почвы, в продукты животноводства они поступают через антибиотики, гормоны для стимуляции роста животных. Как конечное звено пищевой цепи, человек может получать еду с концентрация токсикантов до 1000 раз выше, чем в почвах.
Загрязнение пищевых продуктов происходит при готовке еды, контакте сырья с посудой во время термообработки. При консервировании жестяные банки становятся источником загрязнения свинцом. Он попадает в состав продуктов питания из свинцового припоя в швах.
С чем связана опасность?
В гидросферу тяжелые металлы попадают в ходе природных процессов и в результате человеческой деятельности.

Загрязнение водоемов и водотоков природными тяжелыми элементами происходит тогда, когда пластовые воды растворяют минералы горных пород, а частицы почвы, разрушенной эрозиями, уносятся в водоемы вместе с атмосферными осадками.
Тяжелые металлы берутся в почве, а затем мигрируют в гидросферу в результате трёх естественных процессов в природе:
- Прямое обогащение. Чернозём на Алтае естественно обогащен мышьяком в концентрации 100-150 мг/кг.
- Нарушение баланса между химическими элементами. Содержание мышьяка в странах Южной Азии превышает 200 мкг/л при норме 10 мкг/л. Причина — нарушение буферной роли почвы, в сдвиге оптимального соотношения мышьяка и железа в водонасыщенных осадках, где благодаря присутствию пирита образуется восстановительная среда.
- Активизация литогенных тяжелых элементов. В почве западной части США в фосфоритных месторождениях и сопряженных с ними углистоглинистых сланцах содержится селен (Se) в концентрации 700 мг/кг при норме для почв США 0,4 мг/кг. В момент орошения этих участков для нужд сельского хозяйства селен почвы становится подвижным и переносится в водоемы с потоками дренажной воды. Концентрация Se в телах животных и тканях водолюбивых растений достигает уровня 3000 мг/кг. Гибель скота в штатах Айдахо, Юта и Вайоминг учёные связывают с высоким содержанием селена, содержащегося в воде и растениях этих территорий.
Природное загрязнение гидросферы тяжелыми металлами нельзя игнорировать, но большинство токсичных элементов в воду сбрасывает всё же человек, непрерывно наращивающий масштабы промышленного производства и сельскохозяйственной деятельности.
Помощь при остром отравлении свинцом
Не нужно дожидаться первых симптомов, лечение должно начинаться сразу же, после контакта с ядовитым веществом. Если человек продолжает находиться в помещении с отравленным парами свинца воздухом, следует немедленно вывести его на свежий воздух.
В первую очередь нужно вызвать скорую медицинскую помощь. По телефону детально расскажите диспетчерам о случившемся, назовите свое точное месторасположение.
Во время ожидания медиков можете приступить к оказанию первой помощи. При отравлении свинцом самостоятельно мало чем можно помочь пострадавшему.
- Если свинец попал на кожу – промойте ее простой проточной водой. Обеспечьте больному покой, откройте окна для поступления свежего воздуха.
- При проглатывании свинца следует провести промывание желудка. Для этого нужно выпить залпом литр простой воды комнатной температуры и вырвать ее. Очищение желудка поможет предотвратить всасывание свинца в кровеносное русло.
- При отравлении парами свинца следует дать больному прополоскать ротовую полость и нос простой водой, попить воды, сладкого чая.
Никель (Ni)
На содержание никеля в озерах и реках влияют местные породы. Если рядом с водоёмом находятся месторождения никелевых и железно-никелевых руд концентрации могут быть и ещё больше нормального. Никель может поступить в озера и реки при разложении растениях и животных. Сине-зеленые водоросли содержат рекордные количества никеля по сравнению с другими растительными организмами. Важные отходные воды с высоким содержанием никеля освобождаются при производстве синтетического каучука, при процессах никелирования. Также никель в больших количествах освобождается во время сжигания угля, нефти.
Высокий рН может послужить причиной осаждения никеля в форме сульфатов, цианидов, карбонатов или гидроксидов. Живые организмы могут снизить уровень подвижного никеля, употребляя его. Важны и процессы адсорбции на поверхности пород.
Вода может содержать никель в растворённой, коллоидальной и взвешенной формах (баланс между этими состояниями зависит от рН среды, температуры и состава воды). Гидроксид железа, карбонат кальция, глина хорошо сорбируют соединения содержащие никель. Растворённый никель находится в виде комплексов с фульвовой и гуминовой кислот, а также с аминокислотами и цианидами. Самой стабильной ионной формой считается Ni2+. Ni3+, как правило, формируется при большом рН.
В середине 50ых годов никель был внесён в список микроэлементов, потому что он играет важную роль в разных процессах как катализатор. В низких дозах он имеет положительный эффект на кроветворные процессы. Большие дозы всё-таки очень опасны для здоровья, ведь никель – канцерогенный химический элемент и может спровоцировать разные заболевания дыхательной системы. Свободный Ni2+ более токсичный, чем в форме комплексов (примерно в 2 раза).
Уровень никеля в природных водоёмах
В реках, содержание никеля – 0,8 – 10 мкг/л, а при загрязнении даже несколько десяток микрограммов на литр. В морях в среднем содержание этого металла – 2 мкг/л, а в подземных водохранилищах даже несколько миллиграммов на литр воды. Рядом с породами содержащие никелевые минералы, подземные водохранилища могут содержать до 20 г/л.
Загрязнение почвы тяжелыми металлами
Самые долгие последствия вызывает загрязнение почв тяжелыми металлами вследствие добычи, плавки руд, промышленных выбросов, применения удобрений. Особенно опасны кадмий, медь, свинец, цинк, поскольку они стойкие, биоаккумулятивные и токсичные.
Последствия загрязнения почвы
Из-за загрязнения почв металлами ухудшается рост и метаболизм почвенных микробов. Это может затруднить поглощение растениями питательных веществ из почвы. Плюс тяжелые металлы токсичны для растений. Все это приводят к замедлению роста, низкой урожайности.
Растения, накопившие токсиканты, могут поступать в пищу. Это опасно для здоровья. Еще они из почвы проникают в питьевую воду, вызывая болезни.
Рекультивация земель, загрязненных тяжелыми металлами
Перед рекультивацией земель, загрязненных тяжелыми металлами, важно выявить источник загрязнения, реализовать меры по его ликвидации и уменьшению выбросов. Только так достигается эффективность работ
Рекультивация земельных участков проводится несколькими способами:
- Выращивание устойчивых к загрязнению растений (колосовые зерновые, капуста, картофель, хлопчатник, свекла).
- Фиторекультивация растениями, накапливающими металлы.
- Контроль подвижности токсикантов в почве.
- Регулирование соотношения элементов в почве.
- Организация рекультивационного слоя.
Другие вредные загрязнения питьевой воды
Видов всевозможных загрязнений воды множество. Одних только химических элементов в таблице Менделеева более сотни, а их соединений на несколько порядков больше. Особенно опасны для здоровья тяжелые, драгоценные и редкоземельные металлы. Они быстро накапливаются в организме, но очень медленно из него выводятся. Так же серьезный вред нам могут нанести легкие вещества — соединения азота, хлора, углерода. А микроскопическая живая органика, обитающая в воде, может вызвать массовые отравления, эпидемии и пандемии.
Опасные вещества могут находиться в воде, как в растворенном виде, так и в форме взвесей, осадка. Для удаления нерастворенных веществ успешно применяются обычные проточные фильтры для воды. При этом снижается мутность и цветность воды и повышается ее прозрачность. А для того чтобы удалить из воды растворенные в ней загрязнения необходимо их перевести в нерастворенную форму (окислить), а затем уже физически их отфильтровывать. В качестве окислителя наилучшим образом подходит озон — мощный реагент, с ограниченным временем активности.
Заказать очистку питьевой воды
Железо (Fe)
Железо — химический элемент не редкий, оно содержится во многих минералах и пород и таким образом в природных водоёмах уровень этого элемента повыше других металлов. Оно может происходить в результате процессов выветривания горных пород, разрушения этих пород и растворением. Образуя разные комплексы с органическими веществами из раствора, железо может быть в коллоидальном, растворённом и в взвешенном состояниях. Нельзя не упомнить про антропогенные источники загрязнения железом. Сточные воды с металлургических, металлообрабатывающих, лакокрасочных и текстильных заводов зашкаливают иногда из-за избытка железа.
Количество железа в реках и озерах зависит от химического состава раствора, рН и частично от температуры. Взвешенные формы соединений железа имеют размер более 0,45 мкг. Основные вещества которые входят в состав этих частиц являются взвеси с сорбированными соединениями железа, гидрата оксида железа и других железосодержащих минералов. Более малые частицы, то есть коллоидальные формы железа, рассматриваются совместно с растворенными соединениями железа. Железо в растворённом состоянии состоит из ионов, гидроксокомплексов и комплексов. В зависимости от валентности замечено что Fe(II) мигрирует в ионной форме, а Fe(III) в отсутствии разных комплексов остаётся в растворённом состоянии.
В балансе соединений железа в водном растворе, очень важно и роль процессов окисления, так химического так и биохимического (железобактерии). Эти бактерии ответственны за переход ионов железа Fe(II) в состояние Fe(III)
Соединения трехвалентного железа имеют склонность гидролизовать и выпадать в осадок Fe(OH)3. Как Fe(II), так и Fe(III) склоны к образованию гидроксокомплексов типа —, +, 3+, 4+, +, в зависимости от кислотности раствора. В нормальных условиях в реках и озерах, Fe(III) находятся в связи с разными растворёнными неорганическими и органическими веществами. При рН больше 8, Fe(III) переходит в Fe(OH)3. Коллоидные формы соединений железа самые малоизучены.
Содержание железа в природных водоёмах
В реках и озерах уровень железа колеблется на уровне n*0,1 мг/л, но может повыситься вблизи болот до несколько мг/л. В болотах железо концентрируется в форме солей гуматов (соли гуминовых кислот).
Подземные водохранилища с низким рН содержат рекордные количества железа — до нескольких сотен миллиграммов на литр.
Железо — важный микроэлемент и от него зависят разные важные биологические процессы. Оно влияет на интенсивность развития фитопланктона и от него зависит качество микрофлоры в водоёмах.
Уровень железа в реках и озерах имеет сезонный характер. Самые высокие концентрации в водоёмах наблюдаются зимою и летом из-за стагнации вод, а вот весною и осенью заметно снижается уровень этого элемента по причине перемешивания водных масс.
Таким образом, большое количество кислорода ведёт к окислению железа с двухвалентной формы в трехвалентной, формируясь гидроксид железа, который падает в осадок.
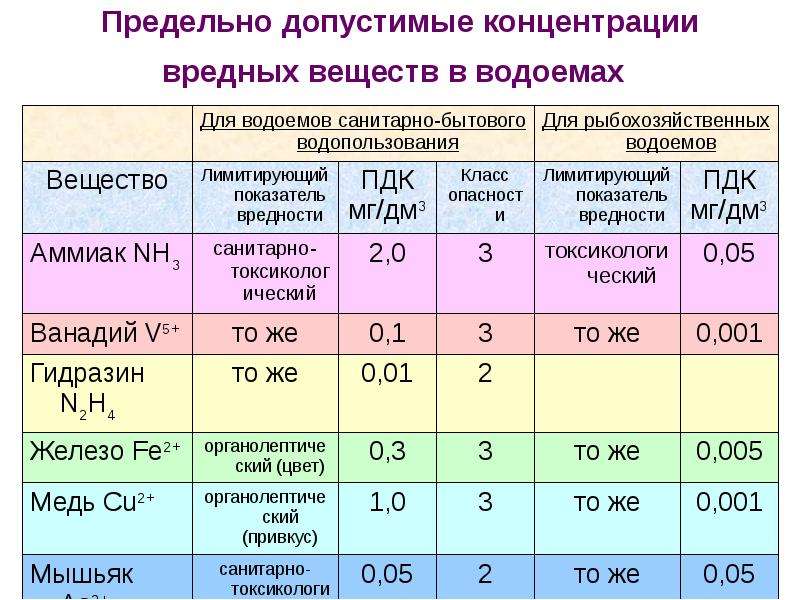
Предельно-допустимая концентрация железа для водной среды
Вода с большим количеством железа (больше 1-2 мг/л) характеризуется плохими вкусовыми качествами. Она имеет неприятный вяжущий вкус и непригодна для промышленных целей.
ПДК железа для водной среды — 0,3 мг/л, для рыбохозяйственных прудов ПДКрыбхоз — 0,1 мг/л, а для морских водоёмов — 0,05 мг/л.