Суточный и годовой ход упругости пара
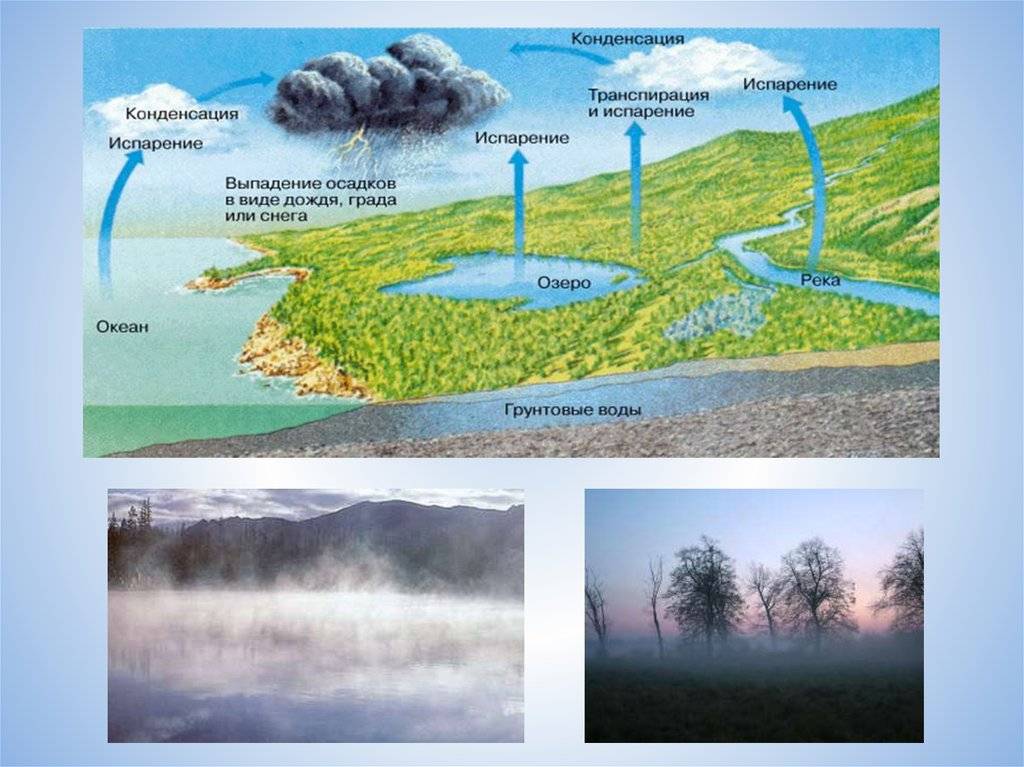
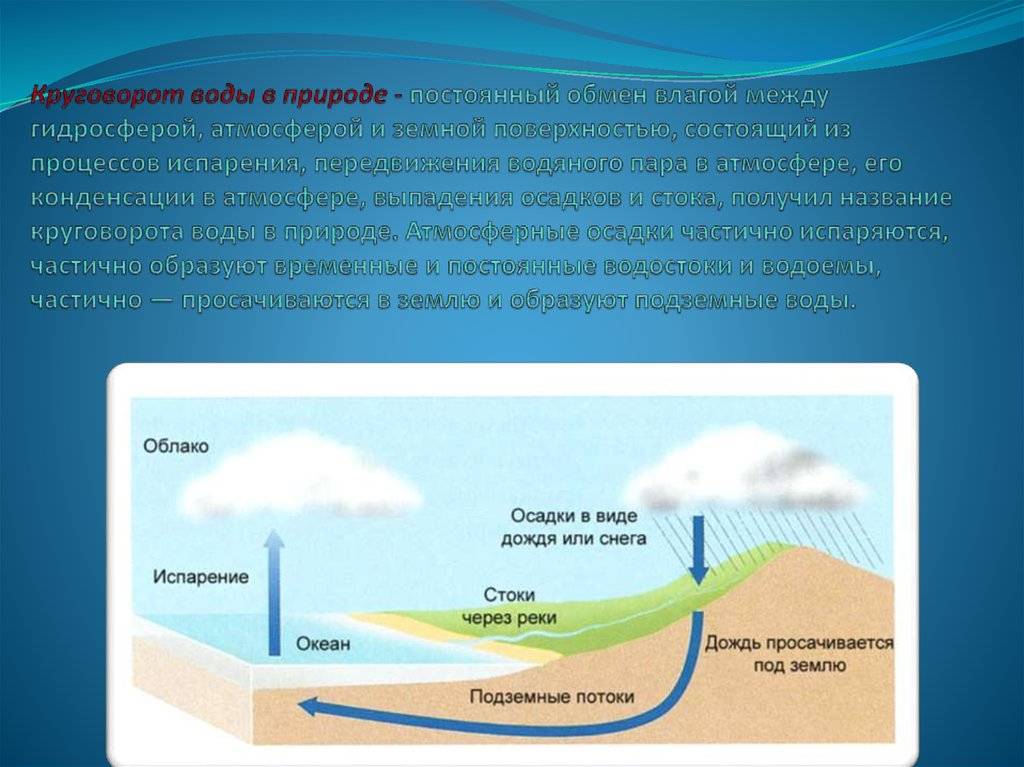
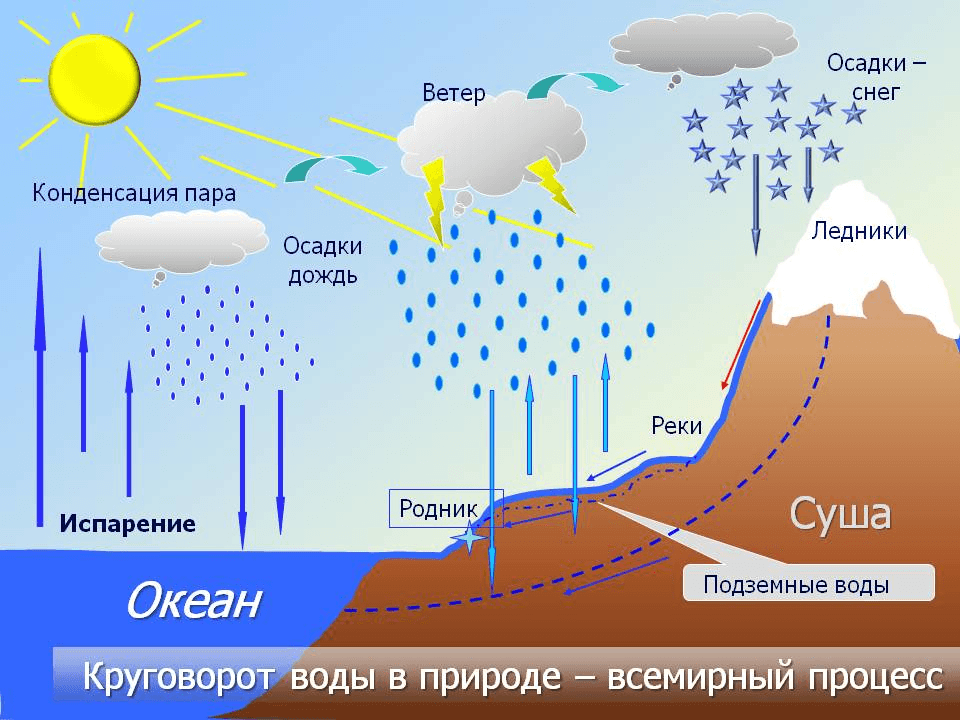
Влагосодержание воздуха у земной поверхности имеет суточный и годовой ход, в общем связанный с соответствующими периодическими изменениями температуры.
Над морем и в приморских областях на суше упругость пара имеет простой суточный ход, параллельный суточному ходу температуры воздуха: влагосодержание растет днем, когда температура выше. Таков же суточный ход в глубине материков в холодное время года. Но в теплое время года в глубине материков упругость пара по большей части имеет двойной суточный ход.
Первый минимум наступает рано утром, вместе с минимумом температуры. Затем упругость пара быстро растет вместе с температурой до девяти утра. После этого упругость пара убывает часов до 15 часов, когда наступает второй минимум. В сухих и жарких местностях этот дневной минимум является главным. Затем упругость пара снова растет до 21-22 часов, когда наступает второй максимум; после этого она снова падает до утра.
Причиной двойного суточного хода влагосодержания является развитие конвекции над сушей летом в дневные часы.
Годовой ход упругости пара параллелен годовому ходу температуры: летом она больше, зимой меньше, что вполне понятно. Самый жаркий и самый холодный месяцы года обыкновенно являются и месяцами с наибольшей и наименьшей упругостью пара.
Годовая амплитуда упругости пара тем больше, чем больше годовая амплитуда температуры. Следовательно, в континентальном климате она больше, чем в морском.
Изменение влажности с высотой
С высотой упругость водяного пара убывает; убывает и абсолютная, и удельная влажность. Это вполне понятно: ведь давление и плотность воздуха в целом также убывают с высотой.
Зная распределение абсолютной влажности по высоте, можно подсчитать, сколько водяного пара содержится во всем столбе воздуха над единицей площади земной поверхности. Эту величину называют осажденной водой. В среднем над каждым квадратным метром земной поверхности в воздухе содержится около 28,5 кг водяного пара. Напомним, что общий вес воздуха над каждым квадратным метром земной поверхности при среднем атмосферном давлении свыше 10 т, т. е. больше в 300 раз.
Динамическое равновесие
Если сосуд, в котором находится жидкость или газ, закупорен, то в таком случае его содержимое может находиться в динамическом равновесии, т.е. скорость процессов конденсации и испарения будет одинаковой (из жидкости будет испаряться столько молекул, сколько возвращается обратно из пара). Такая система получила название двухфазной.
Определение 4
Насыщенный пар – это пар, который находится со своей жидкостью в состоянии динамического равновесия.
Существует зависимость между количеством молекул, испаряющихся с поверхности жидкости в течение одной секунды, и температурой этой жидкости. Скорость процесса конденсации зависит от концентрации молекул пара и скорости их теплового движения, которая, в свою очередь, также находится в прямой зависимости от температуры. Следовательно, можно сделать вывод, что при равновесии жидкости и ее пара концентрация молекул будет определяться равновесной температурой. При повышении температуры необходима высокая концентрация молекул пара, чтобы испарение и конденсация стали одинаковыми по скорости.
Поскольку, как мы уже выяснили, концентрация и температура будут определять давление пара (газа), мы можем сформулировать следующее утверждение:
Определение 5
Давление насыщенного пара p определенного вещества не зависит от объема, но находится в прямой зависимости от температуры.
Именно по этой причине изотермы реальных газов на плоскости включают в себя горизонтальные фрагменты, которые соответствуют двухфазной системе.
Рисунок 3.4.2. Изотермы реального газа. Область I – жидкость, область II – двухфазная система «жидкость + насыщенный пар», область III – газообразное вещество. K – критическая точка.
Если температура будет расти, увеличатся и давление насыщенного пара, и его плотность, а вот плотность жидкости, наоборот, будет снижаться из-за теплового расширения. При достижении критической для данного вещества температуры плотность жидкости и газа уравниваются, после прохождения этой точки физические различия между насыщенным паром и жидкостью исчезают.
Возьмем насыщенный пар и будем сжимать его изотермически при T<Tкр. Его давление будет постепенно возрастать, пока не сравняется с давлением насыщенного пара. Постепенно на дне сосуда появится жидкость, и между ней и ее насыщенным паром возникнет динамическое равновесие. По мере уменьшения объема будет происходить конденсация все большей части пара при неизменном давлении (на изотерме это состояние соответствует горизонтальному участку). После того, как весь пар перейдет в жидкое состояние, давление начнет резко увеличиваться при дальнейшем уменьшении объема, поскольку жидкость сжимается слабо.
Необязательно проходить двухфазную область, чтобы совершить переход от газа к жидкости. Процесс можно провести и в обход критической точки. На изображении такой вариант показан при помощи ломаной линии ABC.
Рисунок 3.4.3. Модель изотермы реального газа.
Воздух, которым мы дышим, при некотором давлении всегда включает в себя водяные пары. Это давление, как правило, меньше, чем давление насыщенного пара.
Определение 6
Относительная влажность воздуха – это отношение парциального давления к давлению насыщенного водяного пара.
В виде формулы это можно записать так:
φ=pp·100%.
Для описания ненасыщенного пара допустимо использовать и уравнение состояния идеального газа с учетом обычных для реального газа ограничений: не слишком большого давления пара (p≤(106–107) Па) и температуры выше значения, определенного для каждого конкретного вещества.
Для описания насыщенного пара применимы законы идеального газа. Однако при этом давление для каждой температуры должно быть определено по кривой равновесия для данного вещества.
Чем выше температура, тем выше давление насыщенного пара. Эту зависимость из законов идеального газа вывести нельзя. При условии постоянной концентрации молекул давление газа будет постоянно возрастать прямо пропорционально температуре. Если пар является насыщенным, то с ростом температуры будет расти не только концентрация, но и средняя кинетическая энергия молекул. Из этого следует, что чем выше температура, тем быстрее растет давление насыщенного пара. Этот процесс происходит быстрее, чем рост давления идеального газа при условии постоянной концентрации молекул в нем.
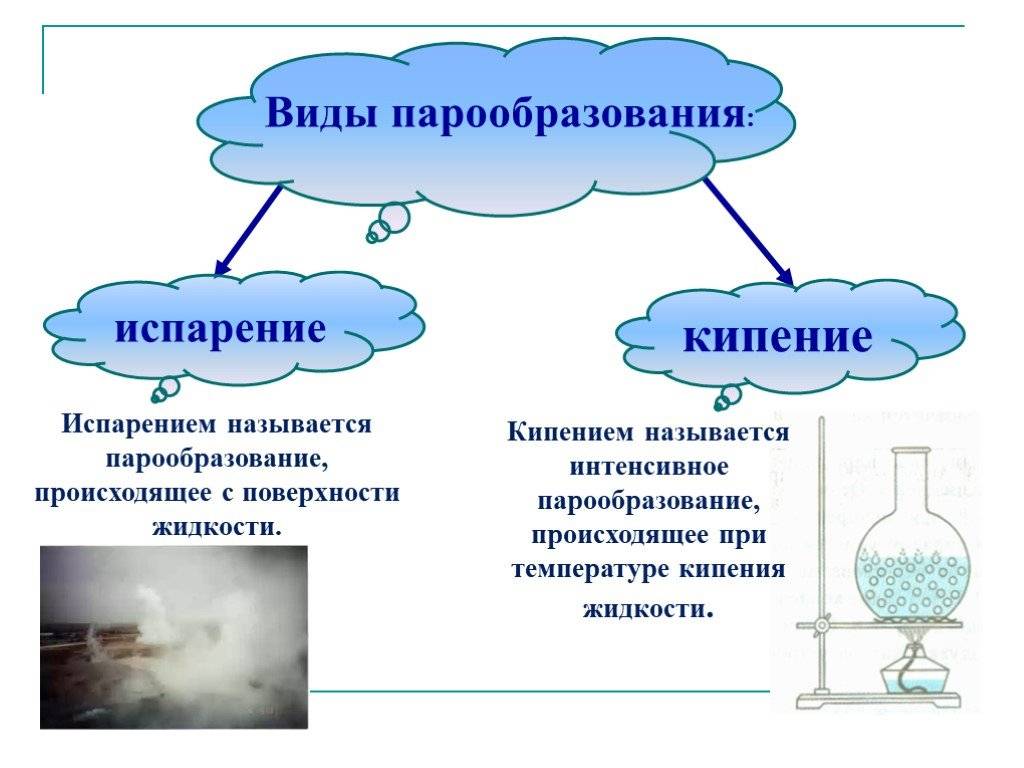
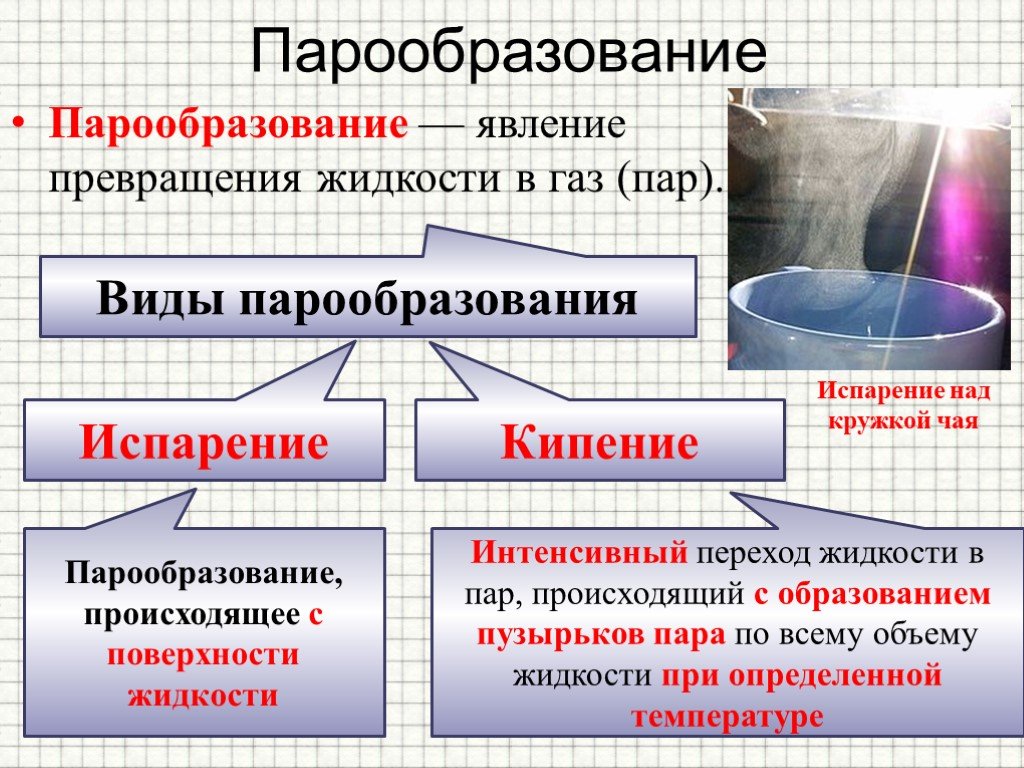
Испарение: что это за процесс
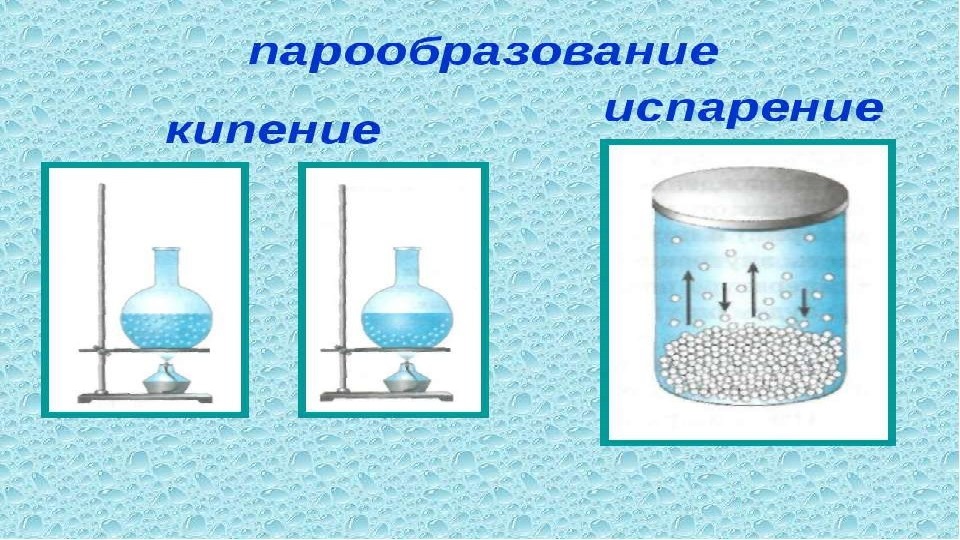
Процесс перехода из жидкого состояния в газообразное называется парообразованием. У этого процесса есть две разновидности: испарение и кипение.
Например, мы заварили себе горячий чай. Над чашкой мы точно увидим пар, так как вода только что поучаствовала в процессе кипения.
Подождите-ка, мы ведь только что сказали, что кипение и испарение — разные вещи. Это действительно так, при этом эти два процесса могут происходить параллельно.
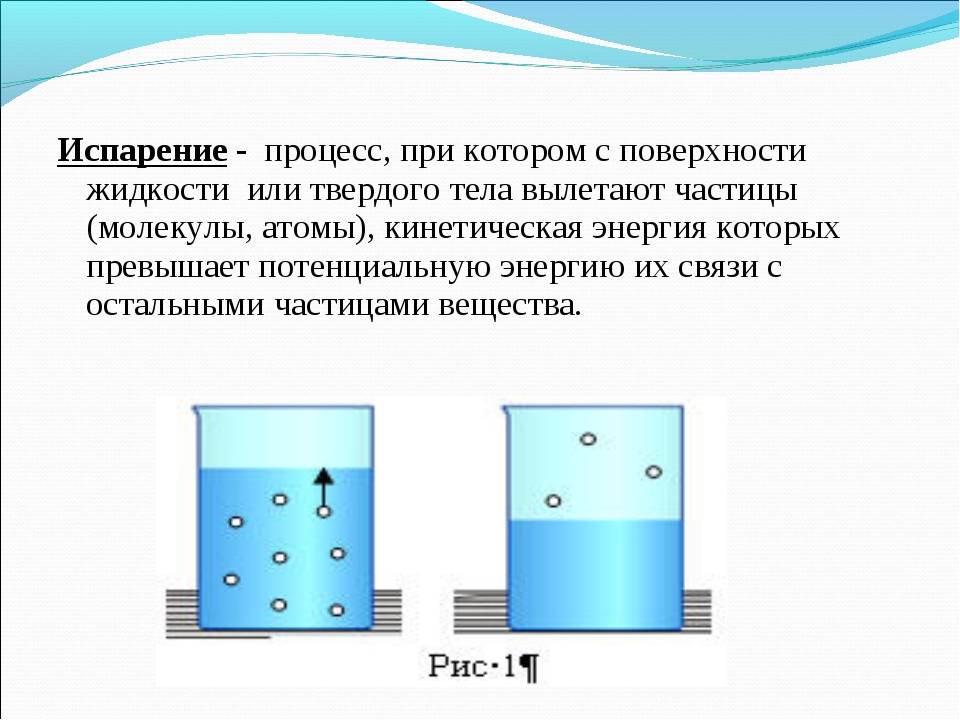
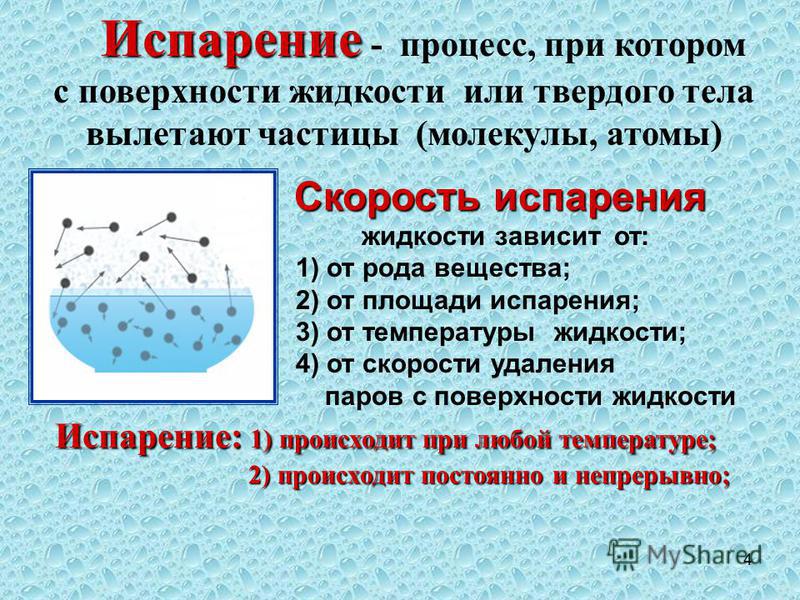
- Испарение — это превращение или переход жидкости в газ (пар) со свободной поверхности жидкости. Если поверхность жидкости открыта и с нее начинается переход вещества из жидкого состояния в газообразное, это будет называться испарением.
- Кипение — процесс интенсивного парообразования, который происходит в жидкости при определенной температуре.
Испарение может происходить и без кипения, просто тогда оно не будет для нас заметно. Например, вода в озере испаряется, хотя мы этого и не замечаем. Кипение по сути своей — это интенсивное испарение, которое вызвали внешними условиями — доведя вещество до температуры кипения.
Физика объясняет испарение тем, что жидкость обычно несколько холоднее окружающего воздуха — из-за разницы температур происходит испарение. Как будто бы это фазовый переход, о котором мы говорим в статье об агрегатных состояниях .
Если нет каких-то внешних воздействий, испарение жидкостей происходит крайне медленно. Молекулы покидают жидкость из-за явления диффузии.
Интересно то, что направление тепловых потоков при испарении может идти в разной последовательности и комбинациях:
ПРИМЕРЫ ЗАДАНИЙ
Часть 1
1. Испарение и кипение — два процесса превращения вещества из одного агрегатного состояния в другое. Общей характеристикой этих процессов является то, что оба они
А. Представляют собой процесс превращения вещества из жидкого состояния в газообразное
Б. Происходят при определённой температуре
Правильный ответ
1) только А
2) только Б
3) и А, и Б
4) ни А, ни Б
2. Испарение и кипение — два процесса перехода вещества из одного агрегатного состояния в другое. Различие между ними заключается в том, что
А. Кипение происходит при определённой температуре, а испарение — при любой температуре.
Б. Испарение происходит с поверхности жидкости, а кипение — во всём объёме жидкости.
Правильным(-и) является(-ются) утверждение(-я)
1) только А
2) только Б
3) и А, и Б
4) ни А, ни Б
3. При нагревании вода превращается в пар той же температуры. При этом
1) увеличивается среднее расстояние между молекулами
2) уменьшается средний модуль скорости движения молекул
3) увеличивается средний модуль скорости движения молекул
4) уменьшается среднее расстояние между молекулами
4. В процессе конденсации водяного пара при неизменной его температуре выделилось некоторое количество теплоты. Что произошло с энергией молекул водяного пара?
1) изменилась как потенциальная, так и кинетическая энергия молекул пара
2) изменилась только потенциальная энергия молекул пара
3) изменилась только кинетическая энергия молекул пара
4) внутренняя энергия молекул пара не изменилась
5. На рисунке приведён график зависимости температуры воды от времени при её охлаждении и последующем нагревании. Первоначально вода находилась в газообразном состоянии. Какой участок графика соответствует процессу конденсации воды?
1) АВ
2) ВС
3) CD
4) DE
6. На рисунке приведён график зависимости температуры воды от времени. В начальный момент времени вода находилась в газообразном состоянии. В каком состоянии находится вода в момент времени \( \tau_1 \)?
1) только в газообразном
2) только в жидком
3) часть воды в жидком состоянии, часть — в газообразном
4) часть воды в жидком состоянии, часть — в кристаллическом
7. На рисунке приведён график зависимости температуры спирта от времени при его нагревании и последующем охлаждении. Первоначально спирт находился в жидком состоянии. Какой участок графика соответствует процессу кипения спирта?
1) АВ
2) ВС
3) CD
4) DE
8. Какое количество теплоты необходимо затратить, чтобы превратить в газообразное состояние 0,1 кг спирта при температуре кипения?
1) 240 Дж
2) 90 кДж
3) 230 кДж
4) 4500 кДж
9. В понедельник абсолютная влажность воздуха днём при температуре 20 °С была равной 12,8 г/см3. Во вторник она увеличилась и стала равной 15,4 г/см3. Выпала ли роса при понижении температуры до 16 °С, если плотность насыщенного пара при этой температуре 13,6 г/см3?
1) не выпала ни в понедельник, ни во вторник
2) выпала и в понедельник, и во вторник
3) в понедельник выпала, во вторник не выпала
4) в понедельник не выпала, во вторник выпала
10. Чему равна относительная влажность воздуха, если при температуре 30 °С абсолютная влажность воздуха равна 18·10-3 кг/м3, а плотность насыщенного пара при этой температуре 30·10-3 кг/м3?
1) 60%
2) 30%
3) 18 %
4) 1,7 %
11. Для каждого физического понятия из первого столбца подберите соответствующий пример из второго столбца. Запишите в таблицу выбранные цифры под соответствующими буквами.
ФИЗИЧЕСКИЕ ПОНЯТИЯ
A) физическая величина
Б) единица физической величины
B) прибор для измерения физической величины
ПРИМЕРЫ
1) кристаллизация
2) джоуль
3) кипение
4) температура
5) мензурка
12. На рисунке приведены графики зависимости от времени температуры двух веществ одинаковой массы, находившихся первоначально в жидком состоянии, получающих одинаковое количество теплоты в единицу времени. Из приведённых ниже утверждений выберите правильные и запишите их номера.
1) Вещество 1 полностью переходит в газообразное состояние, когда начинается кипение вещества 2
2) Удельная теплоёмкость вещества 1 больше, чем вещества 2
3) Удельная теплота парообразования вещества 1 больше, чем вещества 2
4) Температура кипения вещества 1 выше, чем вещества 2
5) В течение промежутка времени \( 0-t_1 \) оба вещества находились в жидком состоянии
Часть 2
13. Какое количество теплоты необходимо для превращения в стоградусный пар 200 г воды, взятой при температуре 40 °С? Потерями энергии на нагревание окружающего воздуха пренебречь.
Примеры затвердевания
- Превратите воду в лед. Если мы удалим тепло (энергию) из воды, пока она не достигнет точки замерзания (0 ° C), жидкость потеряет подвижность и перейдет в твердое состояние: лед.
- Изготовление глиняных кирпичей. Кирпичи изготавливаются из смеси глин и других элементов в полужидкой пасте, которая приобретает свою определенную форму в форме. Оказавшись там, они запекаются, чтобы удалить влагу и вернуть им прочность и устойчивость.
- Магматическая порода. Этот тип породы происходит из жидкой вулканической магмы, которая обитает в глубоких слоях земной коры и которая, вырастая на поверхность, охлаждается, уплотняется и затвердевает, пока не станет твердым камнем.
- Сделать конфету. Сладости получают путем сжигания и плавления сахар обычное, до получения коричневатого жидкого вещества. После того, как вылили в форму, ему дают остыть и затвердеть, получая таким образом карамель.
- Сделать сосиски. Колбасы, такие как чоризо или кровяная колбаса, изготавливаются из крови животных, свертываются и маринуются, вяляются внутри кожи свиного рубца.
- Сделать стекло. Этот процесс начинается со слияния сырье (кварцевый песок, карбонат кальция и известняк) при высоких температурах, пока не будет достигнута нужная консистенция, позволяющая выдувать и придавать форму. Затем смеси дают остыть, и она приобретает характерную твердость и прозрачность.
- Сделать инструменты. Из жидкой стали (сплав железа и углерода) или литья делают различные инструменты и посуда для повседневного использования. Жидкой стали дают остыть и затвердевать в форме, и таким образом получается инструмент.
Узнать больше: Примеры от жидкостей к твердым телам
Измерение влажности воздуха
В приземных условиях влажность воздуха определяется всего удобнее психрометрическим методом, т. е. по показаниям двух термометров – с сухим и со смоченным резервуаром (сухого и смоченного). По разности температур сухого и смоченного термометров вычисляют упругость пара и относительную влажность воздуха.
Пара термометров – с сухим и со смоченным резервуаром – называется психрометром.
Применяют также волосной гигрометр, основанный на том, что обезжиренный волос изменяет свою длину при изменении относительной влажности. Это относительный прибор, который нужно градуировать по психрометру. Принцип волосного гигрометра применяется в самопишущих приборах (гигрографах и метеорографах). Для аэрологических наблюдений применяются также методы определения влажности воздуха по изменению натяжения гигроскопической органической пленки или по химическим реакциям.
Охлаждение испарением
Уже ясно, что только жидкие молекулы, увеличивающие свою кинетическую энергию, изменяют свою жидкую фазу на газообразную.. Одновременно в не вылетевших молекулах жидкости наблюдается уменьшение кинетической энергии с понижением температуры.
Температура жидкости, которая еще сохраняется в этой фазе, падает, она остывает; Этот процесс называется испарительным охлаждением. Это явление позволяет объяснить, почему жидкость, не испаряясь при охлаждении, может поглощать тепло из окружающей среды.
Как упоминалось выше, этот процесс позволяет нам регулировать температуру тела. Этот процесс испарительного охлаждения также используется для охлаждения окружающей среды с помощью испарительных охладителей.
Что такое кипение
Выше мы указывали, что испарение идет в основном с поверхности, но оно также может происходить и из основного объема жидкости. Любое жидкое вещество включает в себя мелкие газовые пузырьки. Если внешнее давление (т.е. давление газа в них) уравнять с давлением насыщенного пара, то произойдет испарение жидкости внутри пузырьков, и они начнут наполняться паром, расширяться и всплывать на поверхность. Этот процесс называется кипением. Таким образом, температура кипения зависит от внешнего давления.
Определение 7
Жидкость начинает кипеть при такой температуре, при которой внешнее давление и давление ее насыщенных паров будут равны.
Если атмосферное давление нормальное, то для кипения воды нужна температура 100 °С. При ней давление насыщенных водяных паров будет равно 1 атм. Если мы будем кипятить воду в горах, то из-за уменьшения атмосферного давления температура кипения снизится до 70 °С.
Жидкость может кипеть только в открытом сосуде. Если его герметично закрыть, то нарушится равновесие между жидкостью и ее насыщенным паром. Узнать температуру кипения при различных значениях давления можно с помощью кривой равновесия.
«Испарение. Конденсация»
Явление превращения вещества из жидкого состояния в газообразное называется парообразованием. Парообразование может осуществляться в виде двух процессов: испарение и кипение.
Испарение
Испарение происходит с поверхности жидкости при любой температуре. Так, лужи высыхают и при 10 °С, и при 20 °С, и при 30 °С. Таким образом, испарением называется процесс превращения вещества из жидкого состояния в газообразное, происходящий с поверхности жидкости при любой температуре.
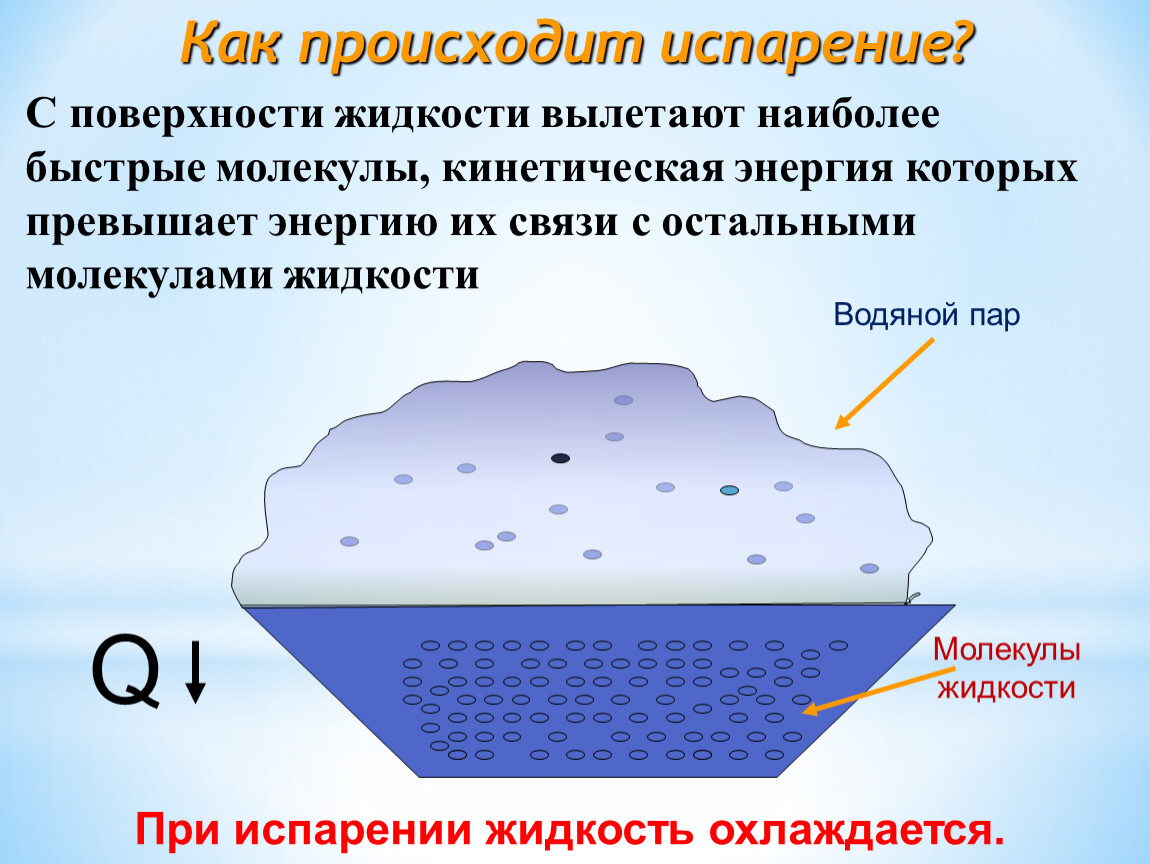
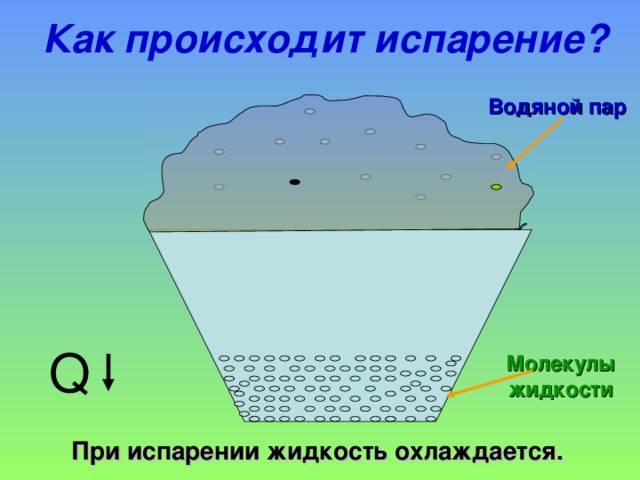
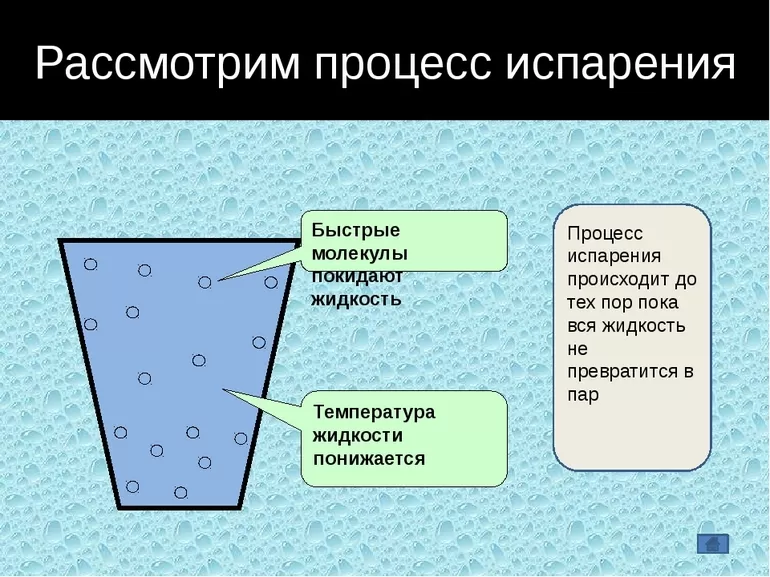
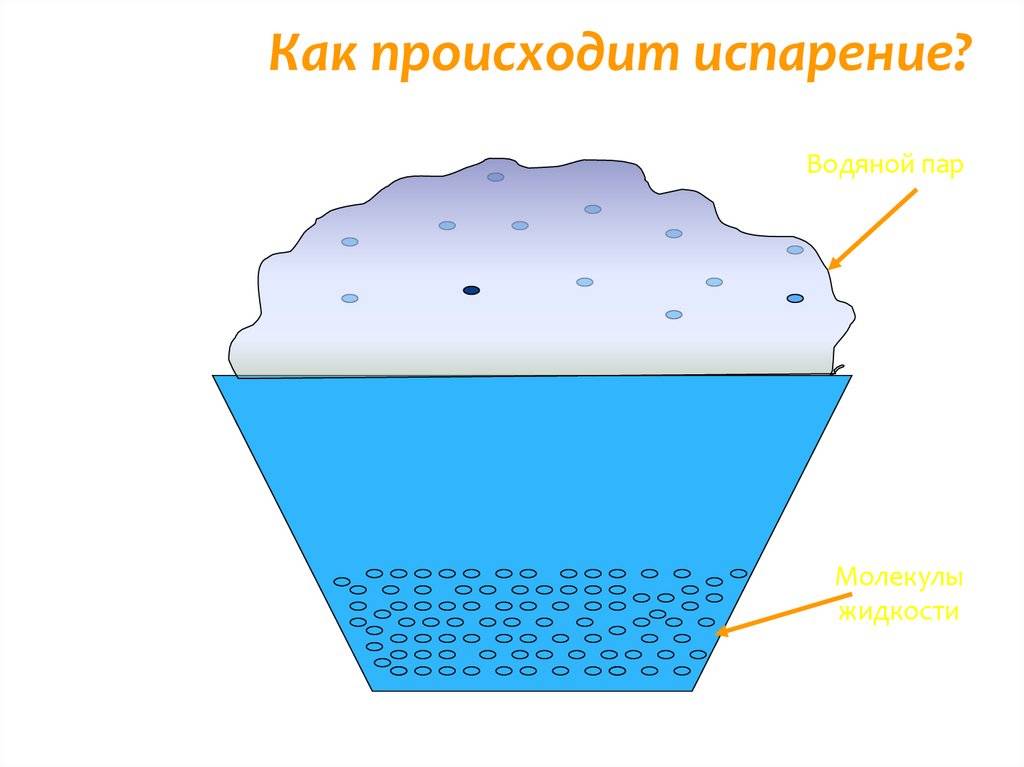
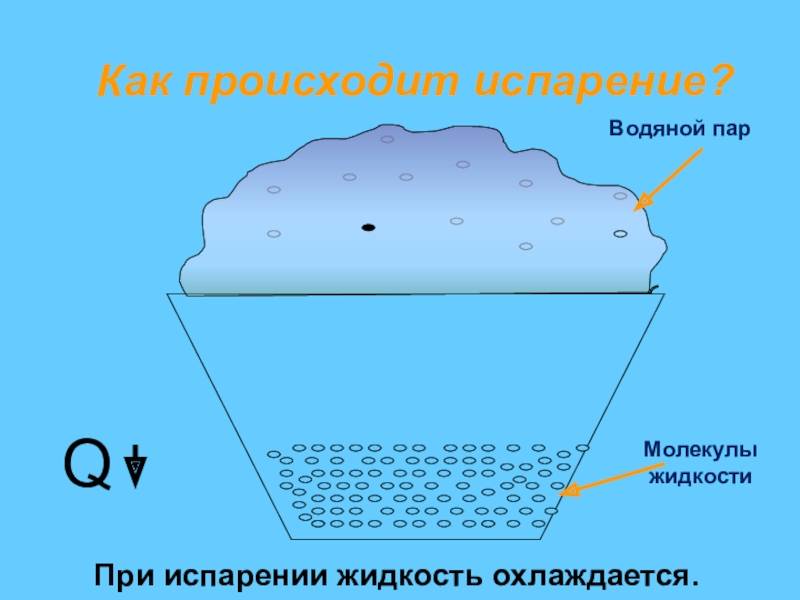
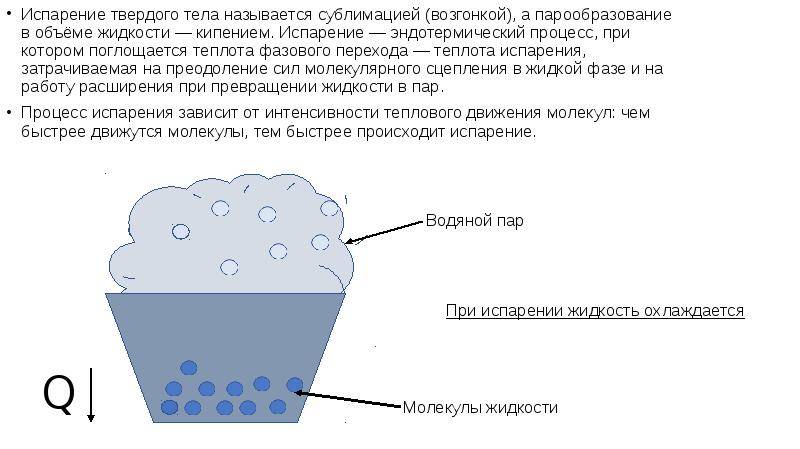
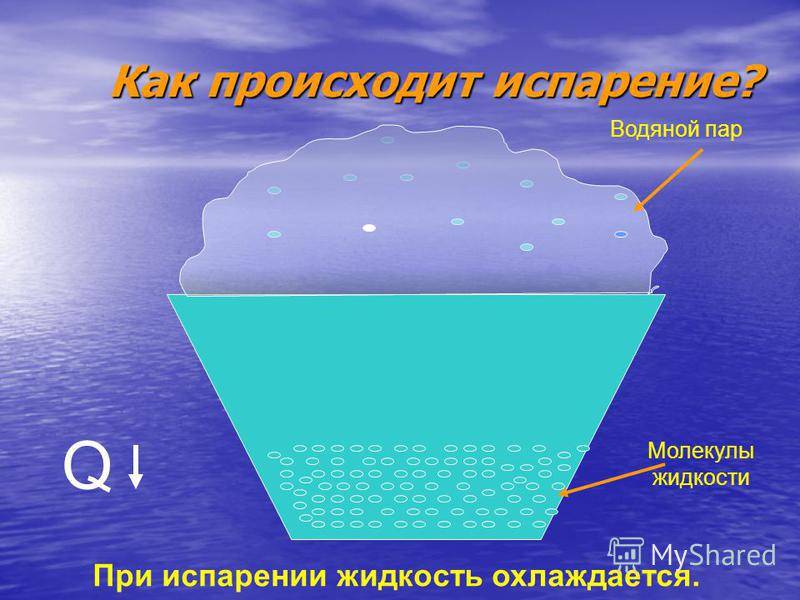
С точки зрения молекулярно-кинетической теории строения вещества испарение жидкости объясняется следующим образом. Молекулы жидкости, участвуя в непрерывном движении, имеют разные скорости. Наиболее быстрые молекулы, находящиеся на границе поверхности воды и воздуха и имеющие сравнительно большую энергию, преодолевают притяжение соседних молекул и покидают жидкость. Таким образом, над жидкостью образуется пар.
Поскольку из жидкости при испарении вылетают молекулы, обладающие большей внутренней энергией по сравнению с энергией молекул, остающихся в жидкости, то средняя скорость и средняя кинетическая энергия молекул жидкости уменьшаются и, следовательно, температура жидкости уменьшается.
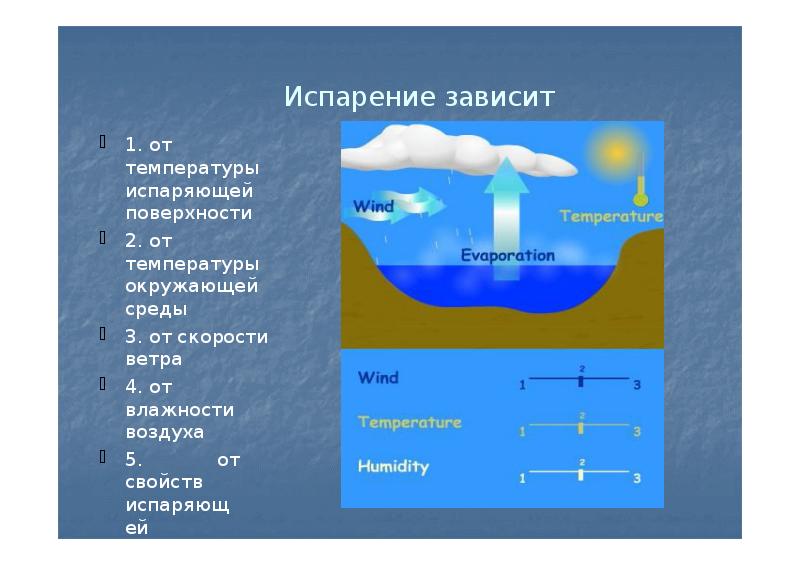
Скорость испарения жидкости зависит от рода жидкости. Так, скорость испарения эфира больше, чем скорость испарения воды и растительного масла. Кроме того, скорость испарения зависит от движения воздуха над поверхностью жидкости. Доказательством может служить то, что бельё сохнет быстрее на ветру, чем в безветренном месте при тех же внешних условиях.
Скорость испарения зависит от температуры жидкости. Например, вода при температуре 30 °С испаряется быстрее, чем вода при 10 °С.
Хорошо известно, что вода, налитая в блюдце, испариться быстрее, чем вода такой же массы, налитая в стакан. Следовательно, скорость испарения зависит от площади поверхности жидкости.
Конденсация
Процесс превращения вещества из газообразного состояния в жидкое называется конденсацией.
Процесс конденсации происходит одновременно с процессом испарения. Молекулы, вылетевшие из жидкости и находящиеся над её поверхностью, участвуют в хаотическом движении. Они сталкиваются с другими молекулами, и в какой-то момент времени их скорости могут быть направлены к поверхности жидкости, и молекулы вернутся в неё.
Если сосуд открыт, то процесс испарения происходит быстрее, чем конденсация, и масса жидкости в сосуде уменьшается. Пар, образующийся над жидкостью, называется ненасыщенным.
Если жидкость находится в закрытом сосуде, то вначале число молекул, вылетающих из жидкости, будет больше, чем число молекул, возвращающихся в неё, но с течением времени плотность пара над жидкостью возрастет настолько, что число молекул, покидающих жидкость, станет равным числу молекул, возвращающихся в неё. В этом случае наступает динамическое равновесие жидкости с её паром.
Пар, находящийся в состоянии динамического равновесия со своей жидкостью, называется насыщенным паром.
Если сосуд с жидкостью, в котором находится насыщенный пар, нагреть, то вначале число молекул, вылетающих из жидкости, увеличится и будет больше, чем число молекул, возвращающихся в неё. С течением времени равновесие восстановится, но плотность пара над жидкостью и соответственно его давление увеличатся.
Конспект урока по физике в 8 классе «Испарение. Конденсация».
Следующая тема: «Кипение. Удельная теплота парообразования».